Олигосахариды хитозана, степень полимеризации 2–8: пребиотический эффект, оказываемый на бифидобактерии bifidium и лактобактерии
Ли Хён Уа, Пак Юн Сонб, Джун Джон Сунб, Син Ун Сопб[1]
а Южная Корея, Вонджу 220-701, Университет Ёнсе, Медицинский колледж Вонджу, Отделение биохимии
б Южная Корея, Канвондо 210–701, Каннын, Наегок-тонг, Медицинский колледж университета Квадон, Отделение микробиологии
Поступила в редакцию 31 августа 2002; получена в пересмотренной формулировке 21 февраля 2003; принята 24 февраля 2003
Аннотация
Определение пребиотического потенциала олигосахаридов хитозана, полученных в результате ферментивного гидролиза полностью деацетелированных полимеров хитозана, необходимо для изучения их воздействия на рост бактерий. В ходе определения степени полимеризации олигосахаридов хитозана с использованием времяпролетной МАЛДИ масс-спектрометрии было выявлено, что олигосахариды хитозана состоят на 33,6% из димеров, на 16,9% из тримеров, на 15,8% из тетрамеров, на 12,4% из пентамеров, на 8,3% из гексамеров, на 7,1% из гептамеров и на 5,9% из октамеров. Обнаружилось, что минимальная подавляющая концентрация (МПК) полимеров хитозана по сравнению с лактобактерями и бифидобактериями не достигает 0,31%. Однако это произошло только в отношении двух штаммов: третью молекулу поместили в питательную среду МРС (по Ману, Рогозе, Шарпу), на 5% состоящую из олигосахаридов хитозана. Воздействие олигосахаридов хитозана на рост бифидобактерий и лактобактерий сравнили с подобного рода воздействием фруктоолигосахаридов. Выяснилось, что фруктоолигосахариды могут способствовать росту только трех штаммов бактерий: бифидобактерии bifidium, бифидобактерии infantis, лактобактерии casei. В то же время, олигосахариды хитозана продемонстрировали возможность стимулировать рост большинства видов лактобактерий и бифидобактерии bifidium KCTC 3440. С повышением концентрации олигосахаридов также увеличивался прирост и удельная скорость роста бифидобактерий bifidium. Помимо этого, время выращивания свидетельствует о высоком бифидогенном потенциале олигосахаридов хитозана. В результате увеличения концентрации олигосахаридов хитозана в закваске на 25%, как рост клеток, так и удельная скорость роста лактобактерий brevis, помещённых в питательную среду МРС, повысилась на 0,1%. Данное исследование доказывает, что олигосахариды хитозана способствуют росту некоторых видов кишечных бактерий, а также что олигосахариды хитозана могут использоваться в качестве пребиотических биологически активных добавок.
Ключевые слова: пребиотик; бифидобактерии; олигосахариды хитозана; стимуляция роста; лактобактерии.
1. Введение
Принято считать, что кишечная микрофлора оказывает огромное воздействие как на желудочно-кишечную функцию в частности, так и на здоровье человека в целом. Вопросу воздействия на кишечную микрофлору посвящен целый ряд исследований [1–3]. Пребиотик – это пищевой ингредиент, который определяется как трудноусваиваемый и благотворно влияет на организм человека, избирательно усиливая рост и активность определенного числа бактериальных видов, живущих в толстом кишечнике [4]. Наиболее известными пребиотиками являются инулин и фруктоолигосахариды (ФОС), которые избирательно стимулируют рост бифидобактерий [5–8].
Работе инулина и ФОС посвящено значительное количество исследований. Пребиотический эффект, оказываемый другими трудноусвояемыми олигосахаридами, такими как ксилоолигосахариды, галактоолигосахариды и изомальтоолигосахариды, также является предметом научных исследований [9–12].
Выделение хитозана происходит посредством щелочного деацетилирования хитина – нерастворимого полимера, получаемого из панцирей ракообразных, таких как раки и креветки [13]. В предыдущих исследованиях отмечалось, что хитозан обладает широким спектром биологической активности, в частности, противораковыми свойствами [14,15], способностью снижать уровень холестерина [16,17], антибактериальными [18,19] и противогрибковыми свойствами [20]. Полимерный хитозан способен растворяться в слабо подкисленной воде. Хитозан обладает большой молекулярной массой, высокой вязкостью и нерастворим при pH выше 6,3 (КД хитозана). Однако у олигомеров хитозана наблюдается низкая вязкость и хорошая растворимость в нейтральном pH. В ряде работ описываются ферментные и химические методы получения олигомеров хитозана [21,22]. Химические методы, однако, предполагают длительную и сложную обработку, в связи с чем ферментный гидролиз хитозана представляется оптимальным с точки зрения создания пищевых добавок. С этой целью было изучено много различных ферментов. Ферменты, способствующие разложению хитозана, были изолированы от бактерий разных видов, в том числе от стрептомицетов [23] и бацилл [24]. Кроме того, обнаружилось, что лизоцим может только частично переваривать деацетилированный хитозан [22,25]. Сообщается, что минимальная подавляющая концентрация (МПК) хитозана варьируется от 0,01% до 1,0% [26,27], а антибактериальные свойства хитозана тесно связаны с его молекулярной массой и ацетилированием [21,28]. Й. Учида и соавторы [29] в своем исследовании отмечают, что МПК слабо гидролизованного хитозана против фузариоза равнялась приблизительно половине МПК нативного хитозана. Большинство исследований, посвященных антибактериальным свойствам гидролизованного хитозана, касаются его противомикробного воздействия на грибки, вызывающие болезни у растений, и лишь малая часть работ посвящена бактериям важным с точки зрения медицины. Существует ограниченное количество исследований, в которых сообщается об опытах in vitro, в ходе которых выявлено, что деполимеризация хитозана может способствовать усилению его противомикробных свойств. Тем не менее, ничего не сообщается о воздействии низкомолекулярного хитозана на бифидо- и лактобактерии, а в предыдущих работах четко не определяется степень полимеризации и деацетилирования гидролизованного хитозана. Основной целью данного исследования является изучение возможности усилить стимулирующее действие олигосахаридов хитозана на бифидо- и лактобактерии c применением определенных олигосахаридов хитозана.
Олигосахариды хитозана, которые были применены в данном исследовании, получены в ходе ферментного гидролиза, а олигомеры хитозана были выделены посредством гель-фильтрации и проанализированы с помощью МАЛДИ масс-спектрометрии. Пребиотические свойства хитозана рассмотрены с учетом МПК, роста и его удельной скорости при взаимодействии с бифидо- и лактобактериями.
2. Материалы и методы исследования
2.1. Материалы и организмы
Материалом исследования послужил полимер хитозана со степенью деацетилирования 99,9% и хитозаназа, полученная из бацилл, любезно предоставленная компанией Kunpoong Bio Co., Ltd, г. Сеул, Корея. ФОС были приобретены у компании Meiji Pharmaceutical Co., Ltd, г. Токио, Япония. Микробная питательная среда была приобретена у компании Difco, США. Прочие химические материалы были получены от компании Sigma, США. И, наконец, стандартные штаммы бифидобактерий, лактобактерий и стрептококка были предоставлены Корейской коллекцией типовых культур (KCTC).
2.2. Культуры и измерения роста
После прохождения бактерией анаэробного инкубационного периода при температуре 37°C на протяжении 24 часов, исходная культура была помещена в 10% глицерин при температуре -70°C на требуемый период времени. Питательная среда МРС (по Ману, Рогозе, Шарпу) была обогащена гидрохлоридом L-цистеина (0,5 г/л), тиогликолятом натрия (0,2 г/л), а в качестве среды для исходной культуры и базовой среды был использован дигидрат хлорида кальция (0,1 г/л). Чтобы изучить влияние различных факторов на рост клеток, бактерии выращивались в ночное время в базальной среде при температуре 37°C и разведены до раствора 106 кл/мл, 50 мл из которых были внесены как посевной материал в 5 мл базальной среды, содержащей ФОС или олигосахариды хитозана. Бактерии выращивались в анаэробных условиях. Затем культуральная жидкость была очищена на центрифуге на скорости вращения 10 000 оборотов в минуту, а получившийся осадок был промыт в фосфатно-солевом буферном растворе (0,1 М фосфатного буфера pH 7,4, 0.9% раствор хлорида натрия) и растворен в фосфатно-солевом растворе от одного до пяти раз. Клетки в растворе были тщательно перемешаны, и аликвотная проба в 100 мл была перемещена на микропластинку с 96 ячейками; с помощью микропланшет-ридера (молекулярное устройство) была измерена оптическая плотность бактерий при 600 нм.
2.3. Антибактериальные свойства
МПК полимеров хитозана и олигосахаридов хитозана в сравнении с различными бактериями были определены с помощью метода двукратного разведения в агаре. На следующий день исходная культуральная среда была помещена в раствор со средой МРС и растворена до стандарта 0,5 по шкале МакФарланда, а затем внесена как посевной материал на агаровую пластинку с базальной средой, обогащенной полимерами хитозана различной концентрации (0–5%). Выращивание бифидобактерий происходило в анаэростатах, выращивание лактобактерий – в аэробных термостатах на протяжении 24-48 часов. После инкубации появление колонии на агарной пластинке было видно невооруженным глазом, а минимальные концентрации, не формирующие колонию, были определены как МПК.
2.4. Получение и состав олигомеров хитозана
Чтобы получить олигомеры хитозана, полимеры хитозана подвергаются гидролизу с применением хитозаназы. Хитозан (2г) был растворен в 100мл раствора 1,5% воды и витамина С. Затем раствор хитозана был инкубирован с 2 единицами хитозаназы при температуре от 4 до 50°C. Олигомеры хитозана были выделены посредством гель-фильтрации, гидролизат нанесли на колонну Bio-gel P10 (2×80 см2) и промыли дистиллированной водой. Частицы олигомеров хитозана были собраны и помещены для сушки в сублимационную сушилку. Полученный белый порошок проанализировали с помощью МАЛДИ масс-спектрометрии (Voyager DE, Perkin–Elmer PerSeptive Biosystem), а затем использован в качестве олигосахаридов хитозана для исследования. Состав олигомеров был рассчитан исходя из максимумов интенсивности на МАЛДИ масс-спектре (Рис. 1). Обнаружилось, что олигосахариды хитозана состоят на 33,6% из димеров, на 16,9% из тримеров, на 15,8% из тетрамеров, на 12,4% из пентамеров, на 8,3% из гексамеров, на 7,1% из гептамеров и на 5,9% из октамеров.
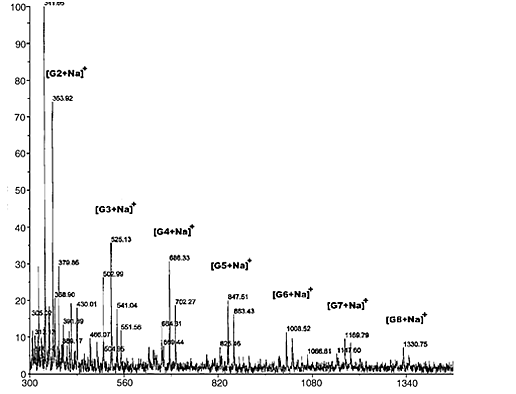
Рис. 1. МАЛДИ масс-спектр олигосахаридов хитозана, зарегистрированные пиковые величины [M+Na]+ димеров (363,92), тримеров (525,13), тетрамеров (686,33), пентамеров (847,51), гексамеров (1008,52), гептамеров (1169,79) и октамеров (1330,75).
3. Результаты
3.1. Противомикробные свойства олигосахаридов хитозана и полимеров хитозана
Было проведено сравнение противомикробного воздействия хитозана на лактобактерии и бифидобактерии и подобного воздействия полимеров хитозана (Таблица 1). Обнаружилось, что при концентрациях 0,16–0,31% полимеры хитозана обладают противокоррозионным действием в отношении бактерий, исследованных в данной работе. Бифидобактерии продемонстрировали рост при 5% олигосахаридов хитозана, в то время как лактобактерии casei – при 2,5% олигосахаридов хитозана. Эти результаты свидетельствуют о том, что олигосахариды хитозана не препятствуют проявлению полезных свойств кишечных бактерий в биологических концентрациях, однако стоит отметить, что лактбактерий brevis и термофильные стрептококки не продемонстрировали роста при концентрации олигосахаридов хитозана 0.63%.
3.2. Влияние олигосахаридов хитозана на рост бактерий
Для изучения влияния олигосахаридов хитозана на рост лактобактерий и бифидобактерий, бактерии выращивались в течение 24 часов при температуре 37°C в среде, обогащенной олигосахаридами хитозана и ФОС 0,1% (Таблица 2). В отличие от ФОС, олигосахариды хитозана оказывали явный стимулирующий эффект на рост бифидобактерий bifidium KCTC 3440. Более того, олигосахариды хитозана сильно стимулировали рост большей части лактобактерий, в то время как ФОС оказали стимулирующее воздействие лишь на три штамма: бифидобактерии bifidium KCTC 3440, бифидобактерии infantis KCTC 3249 и лактобактерии casei KCTC 3109. Эти результаты свидетельствуют о том, что ФОС стимулирует рост лишь ограниченного числа штаммов, в то время как олигосахариды хитозана являются отличными стимуляторами роста бифидобактерий bifidium и большей части лактобактерий, на которых проводилось исследование.
|
Таблица 1 МПК полимеров хитозана и олигосахаридов хитозана |
||
|
Штаммы |
МПК(%) |
|
|
Олигомеры |
Полимеры |
|
|
Бифидобактерия longum KCTC 3421 |
>5 |
0,078 |
|
Бифидобактерия bifidium KCTC 3440 |
>5 |
0,16 |
|
Бифидобактерия breve KCTC 3220 |
>5 |
0,16 |
|
Бифидобактерия adolescentis KCTC 3216 |
>5 |
0,16 |
|
Бифидобактерия infantis KCTC 3249 |
>5 |
0,16 |
|
Лактобактерия brevis KCTC 3498 |
0,63 |
0,31 |
|
Лактобактерия casei KCTC 3109 |
5 |
0,16 |
|
Лактобактерия acidophilus KCTC 3111 |
>5 |
0,16 |
|
Стрептоккок thermophilus KCTC 3658 |
0,63 |
0,31 |
На следующий день исходная культуральная среда была помещена в раствор со средой МРС и растворена до стандарта 0,5 по шкале МакФарланда, а затем внесена как посевной материал на агаровую пластинку с базальной средой, обогащенной полимерами хитозана различной концентрации (0–5%). Выращивание бифидобактерий происходило в анаэростатах, выращивание лактобактерий – в аэробных термостатах на протяжении 24-48 часов. После инкубации, появление колонии на агарной пластинке было видно невооруженным глазом, а минимальные концентрации, не формирующие колонию, были определены как МПК.
3.3. Влияние концентрации олигосахаридов хитозана на рост бифидобактерий bifidium
После того как бифидобактерии bifidium KCTC 3440 выращивались в течение 24 часов при температуре 37°C в питательной среде МРС, обогащенной различными концентрациями олигосахаридов хитозана (0–0,5%) или ФОС (0–0,5%) (Рис. 2), было проведено измерение клеточного роста. Было выявлено, что по сравнению с ФОС олигосахариды хитозана обладают более выраженными стимулирующими свойствами. Рост клеток наблюдался при увеличении концентрации олигосахаридов хитозана до 0,5%. При увеличении концентрации ФОС с 0.25% до 0,5% в базальной среде наблюдался рост бифидобактерий bifidium KCTC 3440. В настоящем исследовании также было изучено влияние времени выращивания на рост клеток (Рис. 3). При увеличении концентрации олигосахаридов хитозана до 0,4% наблюдалось увеличение удельной скорости роста бифидобактерий bifidium KCTC 3440. Клетки в базальной среде с концентрацией олигосахаридов хитозана 0,2% или 0,4% продемонстрировали максимальный рост после 18 часов по сравнению с 24 часами в среде с олигосахаридами хитозана 0,1%. При выращивании бифидобактерий bifidium KCTC 3440 в среде с концентрацией ФОС 0,1-0,2% удельная скорость роста и максимальный рост увеличивались незначительно. Более того, ФОС 0,4% не выявили никакого влияния на рост бифидобактерий bifidium. Эти результаты свидетельствуют о том, что олигосахариды хитозана обладают более сильной способностью увеличивать рост бифидобактерий bifidium по сравнению с ФОС, которые поддерживают бифидогенные свойства первых.
3.4. Влияние олигосахаридов хитозана на максимальный рост и удельную скорость роста лактобактерий
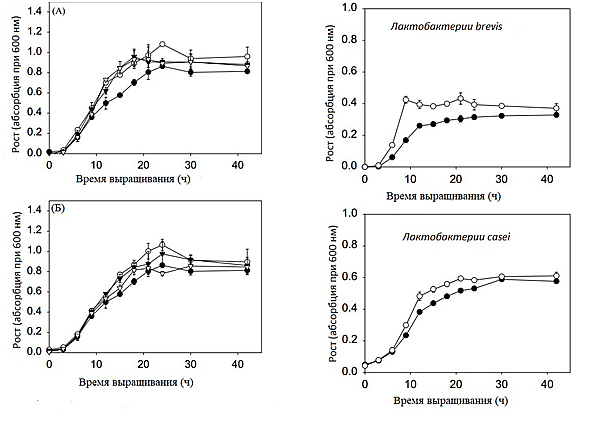
Для того, чтобы изучить влияние олигосахаридов хитозана на максимальный рост и удельную скорость роста лактобактерий brevis KTCT 3498, клетки выращивались в базальной среде, обогащенной олигосахаридами хитозана 0,1%, и рост бактерий был проанализирован с учетом времени (Рис. 4). Клетки достигли максимального роста после 9 часов выращивания с олигосахаридами хитозана 0,1%, учитывая, что для достижения максимального роста в базальной среде требовалось 12 часов. Следовательно, удельная скорость роста увеличилась на 25%. Кроме того, максимальный рост клеток (0,42 OD при 600 нм) в базальной среде с содержанием олигосахаридов хитозана 0,1% был выше на 25%, чем в необогащенной базальной среде. Олигосахариды хитозана проявили свойство значительно усиливать рост лактобактерий brevis KTCT 3498, но лишь незначительно повлияли на рост лактобактерий casei KCTC 3109.
Таблица 2
Влияние олигосахаридов хитозана на клеточный рост лактобактерий и бифидобактерий
|
Штаммы |
Рост (абсорбция при 600 нм) |
|
|
0,1% олигосахариды хитозана + базальная среда |
0,1% ФОС + базальная среда |
|
|
(Базальная среда) |
(Базальная среда) |
|
|
Бифидобактерия longumKCTC 3421 |
0.62070.014 |
0.61170.026 |
|
(0.61070.004) |
(0.61370.015) |
|
|
Бифидобактерия bifidium KCTC 3440 |
0.79470.019 |
0.71670.004 |
|
(0.51670.019) |
(0.66270.042) |
|
|
Бифидобактерия breve KCTC 3220 |
0.42270.077 |
0.56470.030 |
|
(0.43670.072) |
(0.57070.069) |
|
|
Бифидобактерия adolescentis KCTC 3216 |
0.52970.010 |
0.56870.013 |
|
(0.54570.018) |
(0.61270.006) |
|
|
Бифидобактерия infantis KCTC 3249 |
0.72670.017 |
0.86570.037 |
|
(0.77070.005) |
(0.79470.035) |
|
|
Лактобактерия brevis KCTC 3498 |
0.42070.012 |
0.25170.007 |
|
(0.25970.003) |
(0.26570.003) |
|
|
Лактобактерия casei KCTC 3109 |
0.60770.006 |
0.56070.035 |
|
(0.51970.016 ) |
(0.51070.008) |
|
|
Лактобактерия acidophilus KCTC 3111 |
0.57870.066 |
0.54470.011 |
|
(0.50870.008) |
(0.55270.004) |
|
|
Стрептококк thermophilus KCTC 3658 |
0.42070.022 |
0.45570.017 |
|
(0.37970.004) |
(0.44370.037) |
Бактерии выращивались в ночное время в базальной среде при температуре 37°C и разведены до раствора 106 кл/мл, 50 мл из которых были внесены как посевной материал в 5 мл базальной среды, содержащей ФОС или олигосахариды хитозана 0,1%. Бактерии выращивались в анаэробных условиях на протяжении 24 часов при температуре 37°C. Рост клеток был обнаружен за счет оптической плотности при 600 нм. Результаты представлены с учетом среднего ± стандартного отклонения на основании четырех экземпляров.
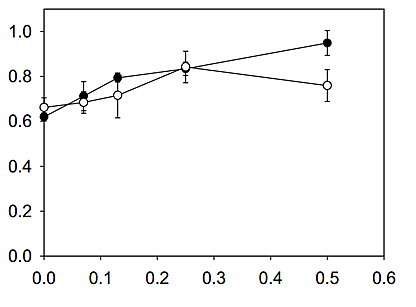
Рис. 2. Воздействие концентраций олигосахаридов на рост бифидобактерий bifidium. Бифидобактерия bifidium KCTC 3440 выращивалась в течение 24 часов в анаэробных условиях в базальной среде, обогащенной различными концентрациями олигосахаридов хитозана (○) и ФОС (●). Результаты представлены с учетом среднего ± стандартного отклонения на основании четырех экземпляров.
4. Обсуждение результатов
Олигомеры хитозана были получены в ходе ферментного гидролиза посредством гель-фильтрации. В ходе МАЛДИ масс-спектрометрии было выявлено, что олигомер был полностью деацетилирован со степенью полимеризации 2–8 (Рис. 1). МАЛДИ масс-спектрометрия подтвердила свою надежность в определении молекулярного веса и степени ацетилизации олигосахаридов хитозана. Существует весьма небольшое число исследований, в которых утверждается, что олигомеры хитозана имеют более сильное противомикробное действие, нежели полимеры хитозана [29,30]. Однако в предыдущих исследованиях степень ацетилизации и молекулярный вес олигосахаридов хитозана четко определены не были. Таким образом, был сделан вывод, что олигомеры хитозана должны смешиваться с частицами хитозана среднего размера. Известно также, что аминный фрагмент и молекулярный вес имеют значение для его биологической активности, особенно, для противомикробной активности [18,19]. В настоящем исследовании олигосахариды хитозана со степенью полимеризации 2–8 не способствуют росту ни бифидобактерий, ни лактобактерий (Рис. 2), однако при очень низких концентрациях (0,078–0,31%) полимеры хитозана оказывают противомикробное действие в отношении бифидобактерий и лактобактерий. На основании этих результатов можно сделать вывод, что олигосахариды хитозана со степенью полимеризации 2–8, несмотря на полное деацетилирование, не обладают противомикробными свойствами. Пребиотики увеличивают рост микробов и являются трудноусвояемыми пищевыми компонентами. Наиболее известными пребиотиками являются инулин и фруктоолигосазариды (ФОС), которые избирательно воздействуют на развитие бифидобактерий [5–8]. ФОС не перевариваются ни кишечными ферментами, ни кишечными бактериями [31]. Однако в бифидобактериях содержится относительно большое количество β-фруктозидазы [32], благодаря чему бифидобактерии могут использовать ФОС как нутриент. Полностью деацетилированный хитозан также не переваривается, а частично ацетилированный хитозан переваривается при помощи лизоцимов. Тем не менее, кишечные ферменты и лизоцимы не могут обеспечить усвоение полностью деацетилированных олигосахаридов хитозана. При концентрациях олигосахаридов хитозана от 0,1% до 0,5% проявляются их бифидогенные свойства (Рис. 2). Более того, при концентрации 0,1% олигосахариды хитозана оказывают стимулирующее воздействие на лактобактерии casei и brevis (Рис. 4). Принимая во внимание тот факт, что механизм стимулирующего воздействия олигосахаридов хитозана неизвестен, результаты исследования свидетельствуют о том, что олигосахариды хитозана могут использоваться как пищевые добавки в пищевой промышленности.
Благодарность
Мы выражаем благодарность компании Kunpoong Bio Co., Ltd за любезно предоставленный нашему исследовательскому проекту хитозан, а также за оказание финансовой поддержки.
|
Рис. 3. Влияние концентрации олигосахаридов хитозана на рост бифидобактерий bifidium при разном времени выращивания. Бифидобактерия bifidium KCTC 3440 была выращена в анаэробных условиях в базальной среде, обогащенной олигосахаридами хитозана (А) и ФОС (Б) различной концентрации. Рост измерялся каждые три часа. (●), 0.1% (○), 0.2%(▼), 0.4%(□). Результаты представлены с учетом среднего ± стандартного отклонения на основании четырех экземпляров. |
Рис. 4. Влияние концентрации олигосахаридов хитозана на рост лактобактерий при разном времени выращивания. Лактобактерияbrevis KCTC 3498 и лактобактерия casei KCTC 3109 выращивались в базальной среде (●), и базальной среде, обогащенной олигосахаридами хитозана 0,1% (○); рост измерялся каждые три часа. Результаты представлены с учетом среднего ± стандартного отклонения на основании четырех экземпляров. |