Хитозан и его производные: свойства и перспективы применения для лечения и борьбы с возрастными заболеваниями
Департамент материаловедения и прикладной химии, Технический университет, Латвия, г. Рига, ул. Азенс 14/24, LV-1048, тел.: +371-292-769-42.
Научный редактор: Паола Лауриенцо
Аннотация: Возрастные болезни, болезни, связанные с питанием и конформационные болезни, такие как атеросклероз, сахарный диабет, рак, гиперхолестеринемия, сердечно-сосудистые и нейродегенеративные заболевания нередко встречаются у старшего поколения. В этой статье рассматриваются аспекты применения хитозана, олигосахаридов хитозана и их производных для лечения и профилактики возрастных заболеваний. Речь также пойдет о влиянии оксидативного стресса, образовании липопротеинов низкой плотности, повышении ригидности тканей, изменениях в конформации белка, хроническом воспалении, вызванном возрастными изменениями. Кроме того, отдельное внимание уделяется применению хитозана в качестве пищевой добавки.
Ключевые слова: хитозан; олигосахариды хитозана; возрастные заболевания; конформация белка.
1. Введение
Как сообщается в недавнем всемирном докладе департамента по экономическим и социальным вопросам ООН, к 2050 году количество пожилых людей (старше 60 лет) до может возрасти до двух миллиардов по сравнению с 2013 годом, когда мировое население равнялось 841 миллиону [1]. С 1990 по 2013 год процент пожилого населения Земли увеличился с 9,2% до 11,7%, и, согласно прогнозам, к 2050 пожилые будут составлять 21,1% от всех живущих на планете людей. Ожидается, что в 2050 году процент престарелых (старше 80 лет) составит 19% от всего пожилого населения (старше 60 лет), по сравнению с 14% по данным 2013 года. Предполагается, что к 2050 году количество живущих на планете людей старше 80 достигнет цифры в 392 миллиона человек. Поскольку продолжительность жизни у женщин больше, чем у мужчин, пожилое население будет преимущественно женского пола.
Качество жизни пожилых людей зависит от питания [2, 3]. Всемирная организация здравоохранения уделяет аспекту питания особое внимание. Возникновение сердечно-сосудистых заболеваний, цереброваскулярных расстройств, диабета, остеопороза, рака и других типичных дегенеративных возрастных заболеваний связано, помимо прочего, с нарушениями в питании [4]. В крови пожилых людей зачастую наблюдается повышенный холестерин, что является фактором риска возникновения сердечно-сосудистых заболеваний. По данным исследований, в результате уменьшения концентрации холестерина в крови на 10%, риск ишемической болезни сердца снижается на 30%. Сокращение потребления соли и насыщенных жиров может снизить концентрацию холестерина в крови, а также обеспечивает понижение артериального давления, что, в свою очередь, снижает риск возникновения заболеваний сердечно-сосудистой системы. Увеличение количества потребляемых овощей и фруктов до двух порций в день позволяет снизить риск сердечно-сосудистых заболеваний на 30% [4].
Людям старшего поколения свойственно ослабление иммунитета [5, 6, 7]. Ухудшение иммунных реакций в большой степени связано с дефицитом таких микроэлементов как цинк, железо, селен, медь, витаминов A, B, C, E. Согласно исследованиям [8], дефицит определенных минералов и витаминов эффективно компенсируется применением аскорбата олигосахаридов хитозана. «Врождённая иммунная система представляет собой клеточную структуру в состав которой входят нейтрофилы, естественные клетки-киллеры и Т-киллеры, моноциты/макрофаги, а также дендроциты, опосредующие взаимодействие с патогенами на самых ранних стадиях. Связанные с возрастом дефекты в процессе активации клеток этого вида выражаются в нарушениях путей сигнальной трансдукции» [9]. Активация регуляторных Т-лимфоцитов и гомеостатическая регуляция микробиоты кишечника могут снимать слабо выраженное воспаление при болезнях, связанных с нарушениями питания [10], а также, вероятно, при возрастных заболеваниях.
В борьбе с возрастными заболеваниями и заболеваниями, связанными с нарушениями питания, немалую роль может играть функциональное питание и биологически активные добавки с антиоксидантными, противовоспалительными, противодиабетическими и противораковыми свойствами. В последнее время появились исследования, направленные на изучение возрастных ухудшений иммунных реакций и роли питания в поддержании и улучшении иммунитета [11]. На фоне процессов старения, определенные питательные вещества способны работать на улучшение иммунитета. Однако молекулярный механизм, лежащий в основе правильного питания и диеты, богатой антиоксидантами, все еще не до конца определен [12]. В новейших исследованиях [13] особое внимание уделяется как полисахаридам с противовоспалительными свойствами, обладающими способностью ингибировать соединения белка и предотвращать возрастные заболевания, так и полисахаридам морских растений и водорослей [14]. Хитозан – это линейный нетоксичный катионный полисахарид природного происхождения, который, благодаря таким характеристикам как биосовместимость, способность к разложению биологическим путём и положительная заряженность, применительно к биомедицинской практике, превосходит полисахариды с нейтральным или отрицательным зарядом. Свойства и различное применение хитозана, его производных и соединений, описаны в ряде опубликованных недавно исследований [15, 16, 17, 18, 19]. Возможности хитозана и его производных в борьбе с возрастными заболеваниями представлены на Схеме 1.
Структуре, свойствам и применению хитозана, олигосахаридов хитозана и их производных посвящено немало обзорных статей [20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30]. Хитозан – это биоактивный катионный полисахарид, обладающий антибактериальными, противогрибковыми, антиоксидантными, противодиабетическими, противовоспалительными и противораковыми свойствами, и он также способен снижать уровень холестерина в крови. Хитозан применяется как в биомедицинских целях, так и в качестве биологически активной добавки. Основная тема этой статьи – применение хитозана и его олигосахаридов в профилактике возрастных расстройств и заболеваний.
2. Оксидативный стресс
В недавних исследованиях ученые пришли к выводу, что антиоксидантные свойства хитина, хитозана и их производных имеют огромное значение для здоровья человека и играют важную роль в питании [31]. В данной статье речь пойдет об аспектах изучения антиоксидантных свойств, не вошедших в вышеупомянутые работы.
Как сообщается в исследованиях, люди пожилого возраста особенно подвержены риску возникновения оксидативного стресса [32]. Повышение уровня реактивных форм кислорода (РФК) может спровоцировать окислительные модификации липидов, белков и ДНК. Оксидативный стресс и воспаления участвуют в развитии возрастных патологий и приводят к заболеваниям сердечно-сосудистой системы, раку, нейродегенеративным болезням, ревматоидному артриту и сахарному диабету (Схема 1). В связи с этим, важным представляется защитить клетки организма от окислительных повреждений, вызванных действием РФК [33, 34, 35].
Схема 1
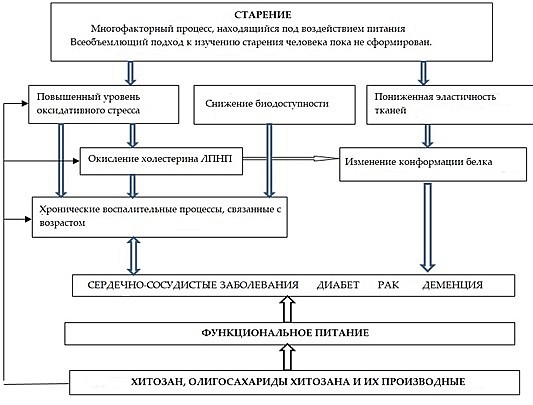
Существует острая необходимость установить роль оксидативного стресса в процессах старения, а также обнаружить способы увеличения эффективности модуляторов оксидативного стресса применительно к лечению и профилактике возрастных заболеваний. В нескольких работах в качестве потенциального способа лечения возрастных патологий, сформировавшихся под влиянием оксидативного стресса, рассматривается применение хитозана и его производных [31, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46]. Японские ученые из университета Фукуямы [43] провели ряд исследований как в естественных, так и в лабораторных условиях и пришли к выводу, что хитозан обладает свойством снижать показатели оксидативного стресса и, тем самым, оказывать прямое антиоксидантное воздействие в рамках кровообращения большого круга.
Исследователи из Хубэйского медицинского университета выявили, что олигосахарид хитозана блокирует как перекисное окисление липидов под влиянием этанола, так и снижение уровня глутатиона посредством активации ядерного фактора (эритроидного происхождения) 2 – фактора транскрипции 2 (Nrf2) и снижения фосфорилирования сигнальных путей p38 MAPK, JNK и ERK [47]. Как следует из экспериментов над крысами, благодаря обогащению рациона хитозаном, в сердечной мышце у грызунов наблюдается снижение оксидативного стресса, индуцированного изопреналином [48], и, кроме того, как у старых, так и у молодых крыс наблюдаются изменения антивозрастного свойства в рамках глутатионзависимой антиоксидантной системы [49]. Также говорится о том, что олигосахариды хитозана защищают мышей от оксидативного стресса [50]. Сульфатированные олигосахариды хитозана снижают образование РФК на внутриклеточном уровне. Китайские ученые из Сианьского транспортного университета [51] выявили, что сульфатированные олигосахариды хитозана защищают β-клетки линий MIN6 поджелудочной железы от разрушений, наносимых перекисью водорода. Сульфатированный олигосахарид хитозана в значительной степени сдерживает образование оксида азота [52], подавляет активность и экспрессию как матричных РНК индуцибельной синтазы оксида азота, так и уровень белков субъединицы p65 ядерного фактора каппа-B (NF-κB) [52], активация которого происходит под воздействием перекиси водорода H2O2. Эти результаты свидетельствуют о высокой антиоксидантной способности сульфатированного олигосахарида хитозана и проливают свет на возможный механизм блокады сигнального пути ядерного фактора каппа-B (NF-κB). Проявление защитных свойств сульфатированного олигосахарида хитозана в борьбе с окислительными повреждениями в клетках линий MIN6 зависит от степени замещения и концентрации. Если рассматривать антиоксидантные возможности хитозана, то, в отличие от хитозана с молекулами, обладающими большим весом, хитозан с низким молекулярным весом более эффективен для предотвращения образования карбонильных групп в белке плазмы крови [53]. Хитозану среднего помола свойственна повышенная антиоксидантная активность. У крыс, питавшихся хитозаном среднего помола, наблюдалась повышенная активность супероксиддисмутазы [54]. Также были исследованы показатели антиоксидатной активности коньюгатов недавно полученных производных хитозана и кофеиновой, феруловой и синаповой кислоты с разными коэффициентами прививки. По сравнению с немодифицированным хитозаном, коньюгаты демонстрируют повышенную антиоксидантную активность [55]. В исследованиях ученых Корейского университета в Сеуле [56] говорится о том, что при лечении и заживлении ран антиоксидантные свойства, обнаруживаемые у комплекса хитозана и полифенолов, содержащихся в зеленом чае, провоцируют активацию трансглутаминазы. Кофеиновая и феруловая кислота прививаются к хитозану свободнорадикально-опосредованным способом [57]. Кроме того, благодаря новым компонентам, была улучшена пероксидация и повышена степень поглощения свободных радикалов. Антиоксидантная активность феноловой кислоты, привитой к хитозану, повысилась в следующем порядке: хитозан < N,О-карбоксиметил хитозан ˂ феруловая кислота < кофеиновая кислота—N,О-карбоксиметил хитозан ˂ галлиевая кислота—N,О-карбоксиметил хитозан [58]. Олигосахариды хитозана снижают степень поражения ДНК в результате оксидации, замедляя действие пероксида водорода H2O2 и угнетая радикалы AAPH (2,2-азобис 2-амидинопропан гидрохлорид), блокируя деградацию ингибирующего каппа B альфа белка (IκB-α) и позволяя ядерному фактору каппа B (NF-κB) транслоцироваться [63]. Транслокация фактора NF-κB из ядра в цитоплазму может быть спровоцирована стрессом, бактериями, воспалительными стимулами, цитокинами, свободными радикалами, канцерогенами и другими агентами. Ядерный фактор NF-κB регулирует синтез ферментов (таких как ЦОГ-2 и индуцибельная синтаза оксида азота – NO-синтаза), цитокинов (TNF, IL-1, IL-6, IL-8), адгезивных молекул, и, помимо этого, связан с такими возрастными заболеваниями, как диабет, остеопороз, болезнь Альцгеймера и рак [64]. Олигосахариды хитозана подавляют активацию фактора NF-κB, поэтому с ними связаны многообещающие перспективы в вопросе предотвращения и лечения возрастных заболеваний.
В недавних публикациях также сообщается, что в результате прививки натуральных антиоксидантных полифенолов к хитозану, олигосахаридам хитозана, и их производным, например, сульфатированным олигосахаридам хитозана антиоксидантного действия [31], могут появиться новые эффективные антиоксидантные нутрицевтики.
3. Воспаление
Оксидативный стресс и воспаление неотступно сопровождают такие возрастные заболевания как рак, сердечно-сосудистые и нейродегенеративные заболевания, ревматоидный артрит и диабет [33, 34, 35]. Хроническое воспаление рассматривается как один из наиболее серьезных факторов риска для возрастных заболеваний [65]. Оксидативный стресс приводит к повышению регуляции провоспалительных медиаторов (TNF-α, интерлейкины IL-1β, IL-6, ЦОГ-2, индуцибельная NO-синтетаза). С концентрацией TNF-α плазмы связаны процессы старения, а также риск возникновения сахарного диабета [66].
Олигосахариды хитозана угнетают синтез интерлейкина IL-6 в эндотелиальных клетках пупочной вены человека (HUVEC), индуцируемых липополисахаридами (ЛПС). Предварительное лечение эндотелиальных клеток пупочной вены человека при помощи олигосахаридов хитозана позволило снизить повышенную экспрессию фосфорилированных сигнальных путей p38 MAPK и ERK1/2, а также ядерного фактора каппа-B (NF-κB). Олигосахариды хитозана препятствовали деградации ингибирующего белка IκBα в факторе NF-κB, как и транслокации NF-κB из цитоплазмы в ядро [67].
Олигосахариды хитозана замедляют повышенное образование воспалительных цитокинов IL-6 и TNF-α, возникшее в результате воздействия ЛПС, в макрофагальных клетках RAW264.7 посредством блокады сигнальных путей MAPK и PI3K/Akt, а также остановки активации фактора NF-κB и подавления активирующего белка-1 (фактора транскрипции AP-1) [68]. Сходное поведение наблюдалось у сульфатированных олигосахаридов хитозана [52]. Недавно было выдвинуто предположение [69], что олигосахариды хитозана блокируют гликолизирование фактора NF-κB (в форме динамической модификации белка β-N-ацетилглюкозамином) и эндотелиальную воспалительную реакцию.
Адгезивные молекулы непосредственно участвуют в адгезионном взаимодействии между эндотелиальными клетками и моноцитами в воспалительном процессе. Олигосахариды хитозана регулируют экспрессию адгезивных молекул – E-селектинов и молекул ICAM-1 – подавляя фосфорилирование путей MAPK и активацию фактора NF-κB в эндотелиальных клетках подвздошной артерии у свиней [70]. Сульфатированный хитозан подавляет P-селектино-опосредованную адгезию клеток HL-60 к лейкоцитам. Сульфохитозан проявляет подавляющую активность в следующем порядке: гепарин > N-сульфатированный/6- O-сульфатированный хитозан ≥ 3-O,6-O-сульфатированный хитозан > 6-O-сульфатированный хитозан >> N-сульфатированный хитозан. Следовательно, можно прийти к выводу, что сульфатирование хитозана по двойной связи является необходимым условием для подавления P-селектино-опосредованной адгезии клеток HL-60 к лейкоцитам [71].
В настоящее время все еще изучается воздействие хитозана и кватернизированного хитозана на образование цитокинов IL-1β и TNF-α в ЛПС-стимулируемых клетках периодонтальной связки человека [72]. Хитозан подавляет синтез цитокинов IL-1β и TNF-α, в то время как кватернизированный хитозан стимулирует синтез IL-1β и TNF-α.
В ходе экспериментов над крысами было выявлено, что у животных с аутоиммунным передним увеитом олигосахариды хитозана смогли ослабить воспаление глаз [73], а также предотвратить возникновение ретинальной ишемии и реперфузионных повреждений благодаря снижению оксидативного стресса и снятию воспаления [74].
В то же время, в ходе другого эксперимента, крыс, страдающих диабетом, в течение 10 недель кормили пищей с содержанием хитозана, что привело к снижению у животных концентрации глюкозы в плазме крови, а также цитокинов TNF-α и IL-6 [75]. Проанализировав биомаркеры, ученые смогли сделать некоторые выводы относительно сложных механизмов заболеваний, что сможет помочь в разработке нутрицевтиков нового поколения. Однако это не означает, что снижение содержания воспалительных биомаркеров позволит полностью предотвратить или излечить диабет и другие возрастные заболевания.
Также было обнаружено, что олигосахариды хитозана угнетают выработку и экспрессию цитокинов TNF-α, IL-6 и IL-1β в ЛПС-стимулируемой микроглии BV2. Олигосахариды хитозана также снижают выработку оксида азота (NO) и простагландина E2 (PGE2) посредством подавления экспрессии индуцибельной синтазы оксида азота – индуцибельной NO-синтазы и ЦОГ-2 (циклооксигеназы-2) [76]. Кроме того, недавно было доказано, что олигосахариды хитозана снижают уровень содержания оксида азота, цитокинов TNF-α и IL-1β, вырабатываемых в ЛПС-стимулируемых клетках RAW264.7 путем подавления активации путей фактора NF-κB [77].
Хитозан также способствует снижению уровня TNF-α в сыворотке и уровней лептина у крыс, которые в ходе эксперимента потребляли пищу с повышенным содержанием жиров [78]. У мышей с воспалением кишечника, потребляющих олигосахариды хитозана, в тканях кишечника наблюдалось подавление фактора NF-κB и снижение синтеза TNF-α и IL-6 [79]. Результаты исследований с участием добровольцев пожилого возраста подтвердили, что пероральное поступление олигосахаридов хитозана в организм приводит к снижению уровней воспалительных цитокинов TNF-α и IL-1β [80]. Также сообщается, что в экспериментах с крысами, прошедших овариэктомию, олигосахариды хитозана, добавляемые в пищу, способствовали насыщению организмов животных кальцием [81]; этот эффект объясняется способностью олигосахаридов хитозана подавлять мРНК и синтез белка ЦОГ-2, основного связующего звена между воспалением и остеопорозом. Как показывают испытания, проводимые в естественных условиях, олигосахариды хитозана способны оказывать противовоспалительный эффект, опосредованный выработкой циклооксигеназы и снижением выработки простагландинов [82].
Необходимо заметить, что целый ряд недавно опубликованных статей посвящен противовоспалительным и противораковым свойствам олигосахаридов хитина и хитозана [83].
4. Сахарный диабет
Одно из недавних исследований посвящено антидиабетическим свойствам хитина, хитозана и их производных [84]. Ученые пришли к выводу, что хитозан и его производные могут применяться в терапевтических целях для борьбы с диабетом, а исследования в будущем должны иметь своей целью повышение эффективности новых производных и соединений хитозана, используемых в составе высокоактивных БАДов (нутрицевтиков) для профилактики диабета и связанных с ним осложнений. Однако аспекту антидиабетических свойств хитозана, его олигосахаридов и производных, не раскрытому в вышеупомянутом исследовании, уделяется особое внимание в данной статье в контексте борьбы с возрастным диабетом.
Для лечения нарушений питания у людей пожилого возраста в настоящее время рекомендуется диета, обогащенная белками. Тем не менее, недавние масштабные исследования с участием большого количества людей, проведенные учеными Лундского университета [85], показали, что на фоне потребления пищи с высоким содержанием белка и, в частности, мяса, подвергшегося технологической обработке, очень часто наблюдается заболевание диабетов 2-го типа. В то же время, снижение возможности заболевания диабетом 2-го типа наблюдается на фоне потребления хлеба, богатого клетчаткой, и злаковых. Инсулинозависимый сахарный диабет, или диабет 2-го типа, представляет собой проблему мирового масштаба, которая с каждым годом становится острее. В ходе исследований, команда исследователей под руководством профессора В. Лонго из Южно-Калифорнийского университета [86] пришла к выводу, что на фоне высокого потребления протеина у обследуемых старше 65 лет наблюдается снижение заболеваемости раком, и также снижение смертности, однако, во всех возрастных категориях у обследуемых наблюдается пятикратное увеличение смертности от диабета. Необходимо также принять во внимание, что сахарный диабет – это фактор риска возникновения старческой деменции, болезни Альцгеймера и сердечно-сосудистых заболеваний. Итак, сейчас наиболее важным представляется создание принципиально новой, комплексно-сбалансированной и безопасной диеты с высоким содержанием белка, а также БАДов для борьбы с нарушениями питания в пожилом возрасте, при употреблении которых риск заболевания диабетом не будет столь высок.
Применение антиоксидантов снижает оксидативный стресс и борется с осложнениями, возникшими в результате заболевания диабетом [87]. Организм человека пожилого возраста нередко страдает от оксидативного стресса, который может привести к повышению пирокисления липидов и развитию сахарного диабета [88, 89]. Экспрессия фактора TNF-α, наблюдаемая у пациентов, нечувствительных к инсулину, а также у больных диабетом, в четыре раза превосходит экспрессию, наблюдаемую у пациентов с чувствительностью к инсулину [90]. Концентрация фактора TNF-α в плазме наиболее часто обнаруживается в пожилом возрасте и предшествует возрастным отклонениям в выработке инсулина. Профессор Т. Миура и работавшая с ним команда ученых [91], в ходе эксперимента над новорожденными мышами со стрептозотоциновым сахарным диабетом, обнаружили, что хитозан имеет свойство понижать глюкозу в крови, а также снижать уровень липидов. В свою очередь, ученые К. Хаяши и М. Ито, в результате эксперимента над мышами с диабетом 2-го типа и сопутствующим ожирением, пришли к выводу, что лактат хитозана обладает антидиабетическим эффектом. Хитозан может обладать потенциалом для облегчения гипогликемии, возникающей на фоне диабета 1-го типа, посредством снижения глюконеогенеза в печени и повышения уровня глюкозы, которая накапливается и участвует в процессах в мышцах скелета [93]. Сообщается, что в ходе клинического испытания, в рамках которого работа осуществлялась в соответствии с методом произвольного выбора в условиях двойной анонимности с контролем по плацебо, пациенты с предрасположенностью к диабету в течение 12 недель получали питание, обогащенное олигосахаридами хитозана, в результате чего было выявлено существенное понижение глюкозы сыворотки крови [94]. В недавних исследованиях с участием людей с нормальным уровнем глюкозы в крови также отмечается, что олигосахариды хитозана (GO2KA1) влияют на уровень глюкозы в крови после приема пищи [95, 96]. Понижение олигосахаридами GO2KA1 уровня глюкозы в крови после приема пищи обусловлено снижением абсорбции глюкозы в тонком кишечнике в результате синтеза ферментов, расщепляющих углеводы. Команде ученых под руководством профессора И. Сие [75] в своих экспериментах, проводимых на крысах с диабетом, удалось наглядно показать, что хитозан обладает способностью снижать уровень адипоцитокинов в плазме и уровень липидов, накапливаемых в печени и подкожно-жировой клетчатке, а также улучшать инсулинорезистентность. На протяжении 10 недель грызуны потребляли хитозан, что привело к тому, что такие обусловленные диабетом показатели, как повышенный уровень TNF-α, IL-6, а также глюкозы в плазме и пониженный адипонектин, были инвертированы. Хитозановые добавки также помогли снизить содержание триглицеридов в печени и холестерина. Основывая свои доводы на эксперименте на крысах, больных диабетом, профессор И. Сие и его команда полагают, что длительный прием хитозана может снизить инсулинорезистентность посредством подавления накопления липидов в печени и подкожно-жировой клетчатке, а также нейтрализации хронического воспаления.
5. Гиперхолестеринемия
Атеросклероз коронарных сосудов зачастую возникает на фоне окисления липопротеина низкой плотности (ЛПНП). Высокие уровни продуктов окисления холестерина в окисленном ЛПНП оказывают токсичное воздействие на эндотелиальные клетки [97, 98]. Избавление от окисленного ЛПНП играет важную роль в защите макрофагов при реакции на воспаление [99]. Такие медиаторы воспаления, как факторы TNF-α, IL-1, а также фактор, стимулирующий образование колоний макрофагов, повышают способность ЛПНП откладываться в эндотелии и гладких мышцах. Противовоспалительные свойства антиоксидантов выражаются в том, что они предотвращают молекулярную адгезию к моноцитам. Антиоксиданты повышают уровень резистентности ЛПНП человека к окислению. Липопротеины высокой плотности угнетают синтез молекул адгезии эндотелиальных клеток, возникающий под воздействием цитокинов [100].
Гипохолестеринемические свойства хитозана отмечаются в большом количестве публикаций [101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111]. Недавно стало известно, что способность хитозана среднего помола снижать триацилглицерол в сыворотке крови, общий холестерин и ЛПНП-холестерин, по своей эффективности выше, чем у обычного хитозана [54]. Кроме того, недавний 12-недельный эксперимент, в ходе которого мышей кормили хитозаном, подвергшимся гамма-облучению (30–100 кГр), наглядно продемонстрировал, что содержание общего холестерина в крови у подопытных грызунов было значительно ниже, чем у грызунов в контрольной группе [112]. Кроме того, роль хитозана в лечении, направленном на снижение уровня липидов, также рассматривалась в работе профессора А.М. Патти и группы ученых под его руководством [113].
6. Рак
В недавнем обзоре [31] было сделано заключение, что образование раковых клеток может быть спровоцировано свободными радикалами. В связи с этим антиоксидантные свойства хитозана могут быть полезными для снижения рисков возникновения рака в организме человека.
Противораковые свойства хитина, хитозана и олигосахаридов хитозана стали темой одной из недавних научных работ [83]. Хитин и олигосахариды хитозана классифицировали как добавки, используемые в борьбе с раком. Однако в ту работу не вошла информация об их противораковых свойствах, что мы и постараемся восполнить в настоящей статье.
Такие полифенолы как куркумин и ресвератрол считаются эффективными природными антиоксидантами, и для того, чтобы доставить их к раковым клеткам, представляется возможным увеличить биодоступность этих элементов за счет инкапсуляции в наночастицы на основе хитозана [114]. Также сообщается, что новейшие катионные куркумин-хитозановые поли (бутиловый цианакрилатные) наночастицы, синтезированные посредством эмульсионной полимеризации, могут улучшить биодоступность гидрофобного куркумина, подавить рост гепатоцеллюлярной карциномы, а также эффективно ослабить ангиогенез опухоли как в лабораторных, так и в естественных условиях [115]. Для доставки лекарственных препаратов к раковым клеткам, команда ученых под руководством профессора Н.С. Реджинольда [116] синтезировала куркумин с биоразлагаемыми термочувствительными хитозановыми поли-g (N-винилкапролактам) наночастицами (TRC-NP) в составе. Результаты исследования свидетельствуют о том, что частицы TRC-NP с содержанием куркумина имеют большой потенциал в развитии в аспекте доставки противораковых лекарств к пораженным клеткам. Противораковый эффект можно объяснить активацией сигнализации (куркумин ингибирует регуляторы апоптоза Bcl-2 и активирует капсазу 9, чтобы запустить апоптоз) и блокадой пролиферации клеток сигнальных путей (таких как MAP-киназный или AKT путь, и пути mTOR) [117, 118, 119, 120, 121]. Наночастицы с содержанием куркумина, покрытые хитозановой оболочкой, также описаны в публикациях ученых из Федерального Университета Санта-Катарины (Бразилия, Флорианополис), Университета Гренобля (Франция, Гренобль). Кроме того, наночастицы с содержанием куркумина, покрытые хитозановой оболочкой, могут применяться при лечении рака полости рта [122]. Благодаря своим мукоадгезивным свойствам и их поликатионной природе, хитозан применялся в создании пленок, непосредственно содержащих наночастицы в хитозановой оболочке, используемых для буккальной доставки куркумина [123]. В качестве биосовместимой мукоадгезивной системы доставки лекарств были разработаны ксилоглюкановые блокирующие поли (ϵ-капролактоновые) сополимерные наночастицы, заключенные в хитозановую оболочку [124]. Хитозан взаимодействует с муцином благодаря возникновению между протонированными аминогруппами хитозана и отрицательно заряженными группами муцина электростатической силы [125].
Также стало известно, что галлат эпигаллокатехина – полифенол, содержащийся в зелёном чае – эффективно сдерживает рост клеток рака простаты [126]. Галлат эпигаллокатехина инкапсулируется в виде нанолипосомы в хитозановой оболочке, и его применение в борьбе с раком груди вызывает много надежд [127].
Частицы тиолированного хитозана, в составе которого содержится куркумин/5-фторурацил в лабораторных исследованиях продемонстрировали противораковый эффект при взаимодействии с раковыми клетками в кишечнике, а в исследованиях в естественных условиях, в свою очередь, было отмечено улучшение биодоступности лекарств [128].
Вырабатываемые N,O-карбоксиметил хитозаном частицы куркумина/5-фторурацила в лабораторных условиях продемонстрировали улучшенное противораковое действие в раковых клетках кишечника HT 29, а в естественных условиях на мышиной модели ими была обеспечена повышенная концентрация вещества в плазме крови [129].
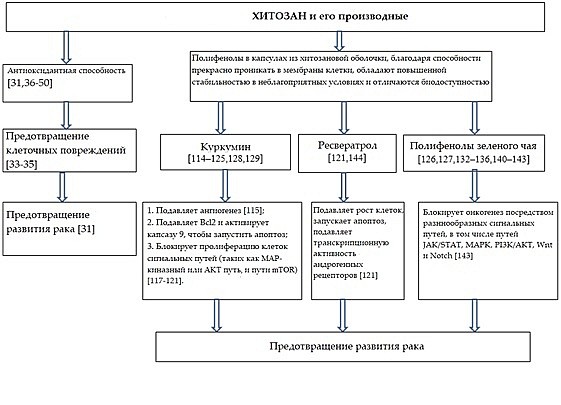
Профессор М. Прабахаран в своем недавнем обзоре уделил внимание разнообразным полезным свойствам хитозановых наночастиц, предназначенных для доставки лекарственных препаратов к раковым клеткам, в частности, таким как биосовместимость, биоразлагаемость, способность прекрасно проникать в мембраны клетки, способности переносить лекарства, пролонгированное и разгрузочное время циркуляции, зависимое от показателей кислотности [130]. Возможное противораковое действие хитозана и полифенолов, инкапсулированных в хитозановые наночастицы, представлены на Схеме 2.
Схема 2. Возможное противораковое действие хитозана и полифенолов, инкапсулированных в хитозановые наночастицы.
7. Наномедицина
В недавних исследованиях было рассмотрено применение хитозана в качестве носителя лекарственных средств [130, 131]. Функциональные нарушения, связанные с возрастом, зачастую обусловлены снижением биодоступности питательных веществ, что являет собой весьма серьезную проблему. В связи с этим применение хитозана в качестве носителя нутрицевтиков в целях профилактики возрастных нарушений – это важная задача, требующая решения.
Катехины – вещества, которые содержатся в зеленом чае – обладают выраженными антиоксидантными, нейрозащитными и противораковыми свойствами. Однако при пероральном применении эти соединения, чувствительные к окислению, сталкиваются с преградами в виде неблагоприятных условий желудочно-кишечного тракта, что снижает их стабильность и препятствует нормальной всасываемости в кишечнике. Инкапсуляция в хитозановую оболочку позволяет улучшить всасываемость катехинов, содержащихся в зеленом чае, а именно положительно заряженных катехинов и отрицательно заряженных галлатов эпигаллокатехина (ЭГКГ) [132]. Исследователи из австралийского университета Монаш полагают, что улучшение всасываемости вещества происходит скорее прочего за счет стабилизации катехинов вследствие инкапсуляции, а вовсе не из-за оказываемого хитозаном воздействия на кишечное парацеллюлярное пространство, пассивной трансцеллюлярной транспортировки или эффекта, оказываемого на эффлюксный белок-транспортер. Оральная абсорбция инкапсулированного ЭГКГ была определена в ходе экспериментов над белыми беспородными мышами. Применение наночастиц хитозана увеличило содержание ЭГКГ в крови при помощи фактора 1.5, близкого к ЭГКГ [133]. Кроме прочего, сообщается о нанохемопревенции инкапсуляции отрицательно заряженного эпигаллокатехин-3-галлата и биоактивных пептидов/хитозановых наночастиц в целях улучшения биодоступности средства [134].
М.В. Танг и ученые из его команды [135] полагают, что наночастицы хитозана с положительным поверхностным зарядом могут временно открывать зазоры в плотных соединениях эпителиальных раковых клеток толстой кишки человека и, как следствие, улучшать транспортировку чайных катехинов в парацеллюлярном пространстве. Ученые подготовили наночастицы, состоящие из хитозана и пищевого полипептида, полимеров (γ-глютаминовая кислота или γ-ПГК) для доставки катехинов, и наглядно продемонстрировали, что хитозановые/ γ-ПГК могут выступать в качестве эффективного носителя для оральной доставки чайных катехинов с высокой антиоксидантной активностью.
Необходимо принять во внимание [136, 137], что, по сравнению с легкорастворимыми полимерами, наночастицы подготовлены посредством ионного желеобразования хитозана, и его квантеризованные производные могут оказывать гораздо меньшее воздействие в процессе снижения трансэпителиального электрического сопротивления путем открытия зазоров в плотных соединениях и на пропускающую способность клеточных уровней в эпителиальных раковых клетках толстой кишки, поскольку количество положительных зарядов на поверхности наночастиц снижено. Однако различий в пропускающей способности между хитозановым препаратом и хитозановыми наночастицами в исследовании эпителия верхних дыхательных путей не обнаружено [138].
Хитозановая оболочка предотвращает агрегацию альбумина бычьей сыворотки (BSA) и наночастиц ЭГКГ при кислотности 4.5–5.0 и может также улучшить всасывание ЭГКГ [139]. Хитозановая оболочка была использована для отрицательно заряженного эпигаллокатехин-3-галлатовых инкапсулированных наноструктурированных липидных носителей [140, 141]. ЭГКГ был инкапсулирован в нанолипозомы с хитозановой оболочкой, и сейчас, в связи с этим, в области профилактики и даже лечения рака груди ожидается настоящий прорыв [127]. В ходе подготовки наночастиц ЭГКГ с оболочкой из хитозана в соединении с фолатом, применялся метод ионного желеобразования с участием гидрохлорида хитозана и карбоксиметил-хитозана, модифицированного фолиевой кислотой, в качестве носителей катехина ЭГКГ [142]. Оказывая воздействие на целый ряд сигнальных путей, включая пути JAK/STAT, MAPK, PI3K/AKT, Wnt и Notch, ЭГКГ таким образом блокирует онкогенезис [143].
Микрокапсулы хитозана/поли (полилактидглиголида PLGA) были изготовлены при помощи метода двойной эмульсии (вода/масло/вода); нутрицевтический ресвератрол был инкапсулирован в микрокапсулы [144].
8. Нейродегенеративные заболевания
Ученые прогнозируют, что количество случаев заболевания болезнью Альцгеймера каждые 20 лет будет увеличивать вдвое и к 2030 достигнет цифры в 66 миллионов, а в 2050 – превысит порог в 115 миллионов [145].
Причиной заболевания Альцгеймера считается хроническая воспалительная реакция, вызванная цитокинами Aβ и IL-1β. Полифенол ЭГКГ напрямую связан с большим количеством белков, причастных к возникновению нарушений формирования структуры белка, и угнетает процесс их фибриллизации [146]. Водорастворимый хитозан обладает способностью угнетать образование провоспалительных цитокинов в клетках глиальной опухоли, активируемых цитокинами Aβ и IL-1β, а также может снижать риски и откладывать по времени возникновение патологических изменений, вызванных заболеванием Альцгеймера [147].
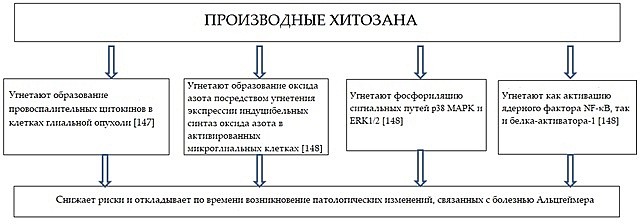
Исследования также были посвящены влиянию олигосахаридов хитозана на образование оксида азота в микроглиальных клетках линии N9 под воздействием ЛПС [148]. Предварительный курс лечения, содержащий олигосахариды хитозана, вследствие подавления экспрессии индуцибельных синтаз оксида азота в активированных микроглиальных клетках, может привести к угнетению образования оксида азота. Также олигосахариды хитозана подавляют фосфориляцию сигнальных путей p38 MAPK и ERK1/2, вызванную активностью ЛПС. Предварительное лечение на основе олигосахаридов хитозана также может привести к угнетению активации как ядерного фактора NF-κB, так и белка-активатора-1 (AP-1). Воздействие, которое олигосахариды хитозана могут оказать на развитие болезни Альцгеймера, проиллюстрировано Схемой 3.
Схема 3. Воздействие олигосахаридов хитозана на развитие болезни Альцгеймера.
9. Конформация белка и конформационные болезни
Возрастные заболевания, в том числе сахарный диабет, катаракта, болезнь Альцгеймера, деменция, атеросклероз, возникают вследствие нарушений в процессе конформации белка и, помимо прочего, классифицируются как конформационные болезни. Окисление или гликирование белков приводит к развертыванию белков с последующей адгезией несвернутых белков к стенкам артерий, сопровождающейся повышением артериальной ригидности и воспалительным процессом в сосудах и атеросклерозом [149, 150, 151, 152, 153, 154]. Атеросклеротические бляшки содержат окисленные ЛПНП, которые обладают амилоидными свойствами [155] и запускают активацию тромбоцитов [151]. Неправильно свернутые белки поддерживают активацию тромбоцитов и их агрегацию, что приводит к возникновению конформационных заболеваний [156, 157].
На изменения в процессе конформации белка также может повлиять наличие воды в липидно-белковой поверхности мембран белка. Как известно, холестерин приводит к снижению содержания воды в двойном липидном слое. В результате изменений степени гидратации могут возникнуть нарушения конформации белка [158]. Хитозан препятствует образованию карбониловых и гидропероксидных групп в сывороточном альбумине, подверженном воздействию перекисных радикалов, и угнетает конформационные изменения в белках, в оценке которых участвуют такие показатели, как спектр поглощения и собственная флуоресценция [159].
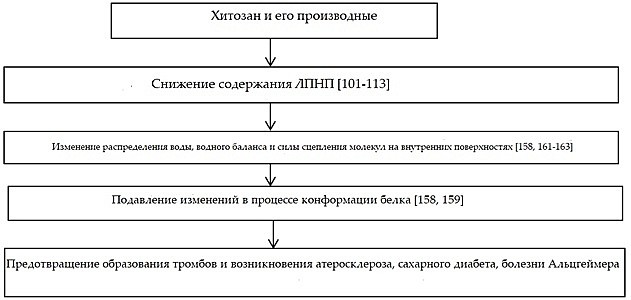
Природные свойства белков могут нарушаться под воздействием различных стрессов. В целях минимизации повреждений и улучшения стабильности протеинов применяется целый ряд вспомогательных веществ [160]. Итак, потенциальный механизм влияния олигосахаридов хитозана на развитие конформационных заболеваний может быть связан с их способностью предотвращать конформационные изменения в белках. Обусловленное возрастными изменениями обезвоживание тканей [161] может привести к изменениям в конформации белков. Потенциальное воздействие хитозана на развитие заболеваний, связанных с изменениями конформации белка, проиллюстрировано Схемой 4. Очевидно, этот аспект нуждается в дальнейшем изучении.
Схема 4. Потенциальное воздействие хитозана на содержание ЛПНП, водный баланс, конформацию белка и развитие конформационных болезней.
В то же время, исследования показали, что присутствие хитозана может стать причиной изменений в перемещении и распределении воды в таких пищевых продуктах, как хлеб [162], а также повлиять на взаимодействие и распределение воды между глютеном и крахмалом. Помимо этого, хитозан может предотвратить адгезию тромбоцитов к имплантам в случае, если молекулы воды прочно прикрепляются к макромолекулам хитозана, однако, в случае, если к поверхности хитозановой оболочки молекулы не прикреплены или прикреплены непрочно, адгезия тромбоцитов не предотвращается [163]. В обоих случаях взаимодействие с белками обусловлено силой сцепления молекул воды с макромолекулами хитозана.
10. Продукты с содержанием хитозана
Было бы прекрасно, если бы добавки для укрепления здоровья на постоянной основе входили в рацион обычного человека, чтобы в пожилом возрасте людям не приходилось кардинально менять свое питание. Таким образом, наиболее распространенными вариантами функционального питания могли бы стать хлеб и молочные продукты, обогащенные хитозаном.
10.1. Хлеб, содержащий хитозан и его производные
В своем обзоре профессор Х.К. Но и соавторы рассматривают исследования, опубликованные до 2007 года, в которых сообщается, что покрытие хлеба пленкой из хитозана [165, 166] и олигосахаридов хитозана [167] продлевает срок его хранения.
Увеличение срока хранения хлеба объясняется тем, что благодаря замедлению ретроградации крахмала рост микробов угнетается. В целях увеличения срока хранения хлеба, молекулы хитозана с большим весом (30 и 120 кДа) считаются более эффективными, нежели молекулы с более низким весом (1 и 5 кДа).
К концу исследования было выявлено, что в крови у пациентов, на протяжении 12 недель употребляющих в пищу хлеб, обогащенный хитозаном, наблюдалось снижение среднего уровня ЛПНП и значительное повышение уровня холестерина липопротеинов высокой плотности [101].
В то же время было отмечено, что из-за хитозана хлеб черствеет быстрее [162]. Однако по сравнению с хитозаном с молекулами среднего веса, олигосахариды хитозана и хитозан с более низким молекулярным весом гораздо в меньшей степени способствуют быстрому зачерствению хлеба [170].
Удельный объем белого хлеба и хлеба, обогащенного протеином, может повышаться за счет добавления микрокристаллического хитина [171]. Изучению свойств хлеба, содержащего хитозан, был посвящён ряд научных публикаций [172, 173, 174, 175, 176, 177].
В Японии и Корее применение хитозана в качестве пищевой добавки было одобрено в 1995 и 1983 годах соответственно. В США решением Управления по контролю за качеством пищевых продуктов и лекарственных средств хитозан был официально признан безопасным [154], и, в связи с этим, успешно применяется в качестве пищевой добавки.
10.2. Молочные продукты с содержанием хитозана и его производных
Ряд научных публикаций посвящен изучению молочных продуктов с содержанием хитозана [164, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190]. Содержащиеся в мороженом микоинкапсулированные пробиотические бактерии, заключенные в хитозановую оболочку, демонстрируют гораздо более высокую выживаемость во время хранения, нежели обычные бактерии [181]. Сообщается, что олигосахариды хитозана обладают свойством подавлять ферментацию в сметане [184], а хитозан способен предотвращать скисание термостатного йогурта во время хранения в холодильнике [185]. Также, в результате повышения концентрации хитозана с высоким молекулярным весом, наблюдается повышение вязкости сметаны, а сниженная концентрация олигосахаридов, в свою очередь, ведет к аномальному снижению вязкости [184].
Выводы и направления дальнейших исследований
Хитозан и олигосахариды хитозана, благодаря своим антиоксидантным, противовоспалительным, противодиабетическим и противораковым свойствам, вызывают огромный интерес в связи с возможностью применения при профилактике и лечении возрастных расстройств и заболеваний, а также для снижения рисков и отсрочки их возникновения. Способность хитозана снижать уровень холестерина уменьшает риск возникновения атеросклероза и сердечно-сосудистых заболеваний, связанных с возрастными изменениями. Хитозан обладает свойством снижать уровень общего холестерина и холестерина липопротеинов низкой плотности, предотвращать окислительные процессы, менять распределение молекул воды во внутренних поверхностях, а также оказывать воздействие на конформацию белковых молекул. Это означает, что хитозан может быть использован для борьбы с заболеваниями, связанными с изменениями конформации белка, которые в свою очередь часто наблюдаются у людей преклонного возраста. Мукоадгезивные свойства хитозана могут найти применение в наномедицине в целях улучшения эффективности биологически активных добавок и систем доставки лекарственных средств. Много перспектив открывается также при рассмотрении работы хитозана и олигосахаридов хитозана в сочетании с полифенольными антиоксидантами. Олигосахариды хитозана подавляют активацию ядерного фактора каппа-В (NF-κB) и его транслокацию из цитоплазмы в ядро – процессы, с которыми связаны определенные возрастные заболевания.
Развитие новых производных таких олигосахаридов хитозана в соединении с серной кислотой, карбоновой кислотой и фенокислотой, их применение в новейших нанопартикулированных лекарственных формах, биологически активных добавках и продуктах функционального питания, может значительно способствовать увеличению биодоступности и стабильности биоактивных компонентов. В сфере наномедицины новые возможности применения могут обнаружить мукоадгезивные пленки, в которых содержатся наночастицы, покрытые хитозановой оболочкой. Очевидно, что в вопросах профилактики и борьбы с возрастными заболеваниями, наука в будущем сможет прийти к принципиально новым решениям.
References
1. United Nations, Department of Economic and Social Affairs, Population Division. World Population Ageing 2013; ST/ESA/SER.A/348; United Nations: New York, NY, USA, 2013. [Google Scholar]
2. Brownie, S. Why are elderly individuals at risk of nutritional deficiency? Int. J. Nurs. Pract. 2006, 12, 110–118. [Google Scholar] [CrossRef] [PubMed]
3. Wells, J.L.; Dumbrell, A.C. Nutrition and aging: assessment and treatment of compromised nutritional status in Frail elderly patients. Clin. Interv. Aging 2006, 1, 67–79. [Google Scholar] [CrossRef] [PubMed]
4. World Health Organization Media centre. Available online: http://www.who.int/mediacentre/factsheets/fs312/en... (accessed on 16 November 2014).
5. Chandra, R.K. Nutrition and the immune system from birth to old age. Eur. J. Clin. Nutr. 2002, 56, 73–76. [Google Scholar] [CrossRef]
6. Chandra, R.K. Nutrition and the immune system: An introduction. Am. J. Clin. Nutr. 1997, 66, 460–463. [Google Scholar]
7. Chandra, R.K. Nutrition, immunity and infection: From basic knowledge of dietary manipulation of immune responses to practical application of ameliorating suffering and improving survival. Proc. Natl. Acad. Sci. USA 1996, 93, l4304–14307. [Google Scholar]
8. Kirilenko, Y.K.; Dushkova, Z.G.; Cherkasova, E.I.; Sigilietov, A.E. Chitosan oligomer and ascorbic acid salt in compensation of deficiency of some micronutrients. In Advances in Chitin Science; Senel, S., Varum, K.M., Sumnu, M.M., Hincal, A.A., Eds.; TUBITAK: Antalya, Turkey, 2007; Volume 10. [Google Scholar]
9. Shaw, A.C.; Joshi, S.; Greenwood, H.; Panda, A.; Lord, J.M. Aging of the innate immune system. Curr. Opin. Immunol. 2010, 22, 507–513. [Google Scholar] [CrossRef] [PubMed]
10. Magrone, T.; Perez de Heredia, F.; Jirillo, E.; Morabito, G.; Marcos, A.; Serafini, M. Functional foods and nutraceuticals as therapeutic tools for the treatment of diet-related diseases. Can. J. Physiol. Pharm. 2013, 91, 387–396. [Google Scholar] [CrossRef]
11. Pae, M.; Meydani, S.N.; Wu, D. The role of nutrition in enhancing immunity in aging. Aging Dis. 2012, 3, 91–129. [Google Scholar] [PubMed]
12. Maijó, M.; Clements, S.J.; Ivory, K.; Nicoletti, C.; Carding, S.R. Nutrition, diet and immunosenescence. Mech. Ageing Dev. 2014, 136–137, 116–128. [Google Scholar] [CrossRef] [PubMed]
13. Li, H.; Ma, F.; Hu, M.; Ma, C.W.; Xiao, L.; Zhang, J.; Xiang, Y.; Huang, Z. Polysaccharides from medicinal herbs as potential therapeutics for aging and age-related neurodegeneration. Rejuvenation Res. 2014, 17, 201–204. [Google Scholar] [CrossRef] [PubMed]
14. d’Ayala, G.G.; Malinconico, M.; Laurienzo, P. Marine derived polysaccharides for biomedical applications: Chemical modification approaches. Molecules 2008, 13, 2069–2106. [Google Scholar] [CrossRef] [PubMed]
15. Chitin and Chitosan Derivatives: Advances in Drug Discovery and Developments; Kim, S.K., Ed.; CRC Press: Boca Raton, FL, USA, 2013; p. 527.
16. Chitosan-Based Hydrogels: Functions and Applications; Yao, K., Li, J., Yao, F., Yin, Y., Eds.; CRC Press: Boca Raton, FL, USA, 2011; p. 241.
17. Chitosan for Biomaterials I; Jayakumar, R., Prabaharan, M., Muzzarelli, R.A.A., Eds.; Springer: Berlin Heidelberg, Germany, 2011; p. 243.
18. Chitosan for Biomaterials II; Jayakumar, R., Prabaharan, M., Muzzarelli, R.A.A., Eds.; Springer: Berlin Heidelberg, Germany, 2011; p. 223.
19. Green Biorenewable Biocomposites: From Knowledge to Industrial Applications; Thakur, V.K., Kessler, M.R., Eds.; CRC Press: Boca Raton, USA, 2015; p. 568.
20. Xia, W.; Liu, P.; Zhang, J.; Chen, J. Biological activities of chitosan and chitooligosaccharides. Food Hydrocolloids 2011, 25, 170–179. [Google Scholar] [CrossRef]
21. Kumar, M.N.V.R. A review of chitin and chitosan applications. React. Funct. Polym. 2000, 46, 1–27. [Google Scholar] [CrossRef]
22. Rinaudo, M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci. 2006, 31, 603–632. [Google Scholar] [CrossRef]
23. Kumar, M.N.V.R.; Muzzarelli, R.A.A.; Muzzarelli, C.; Sashiwa, H.; Domb, A.J. Chitosan chemistry and pharmaceutical perspectives. Chem. Rev. 2004, 104, 6017–6084. [Google Scholar] [CrossRef] [PubMed]
24. Dash, M.; Chiellini, F.; Ottenbrite, R.M.; Chiellini, E. Chitosan—A versatile semi-synthetic polymer in biomedical applications. Prog. Polym. Sci. 2011, 36, 981–1014. [Google Scholar] [CrossRef]
25. Anitha, A.; Sowmya, S.; Sudheesh Kumar, P.T.; Deepthi, S.; Chennazhi, K.P.; Ehrlich, H.; Tsurkan, M.; Jayakumar, R. Chitin and chitosan in selected biomedical applications. Prog. Polym. Sci. 2014, 39, 1644–1667. [Google Scholar] [CrossRef]
26. Zhang, J.; Xia, W.; Liu, P.; Cheng, Q.; Tahi, T.; Gu, W.; Li, B. Chitosan modification and pharmaceutical/biomedical applications. Mar. Drugs 2010, 8, 1962–1987. [Google Scholar] [CrossRef] [PubMed]
27. Jung, W.J.; Park, R.D. Bioproduction of chitooligosaccharides: Present and perspectives. Mar. Drugs 2014, 12, 5328–5356. [Google Scholar] [CrossRef] [PubMed]
28. Muzzarelli, R.A.A.; El Mehtedi, M.; Mattioli-Belmonte, M. Emerging biomedical applications of nano-chitins and nano-chitosans obtained via advanced eco-friendly technologies from marine resources. Mar. Drugs 2014, 12, 5468–5502. [Google Scholar] [CrossRef] [PubMed]
29. Laurienzo, P. Marine polysaccharides in pharmaceutical applications: An overview. Mar. Drugs 2010, 8, 2435–2465. [Google Scholar] [CrossRef] [PubMed]
30. Thakur, V.K.; Thakur, M.K. Recent advances in graft copolymerization and applications of chitosan: A review. ACS Sustain. Chem. Eng. 2014, 2, 2637–2652. [Google Scholar] [CrossRef]
31. Ngo, D.H.; Kim, S.K. Antioxidant effects of chitin, chitosan and their derivatives. In Marine Carbohydrates: Fundamentals and Applications, Part B; Kim, S.-K., Ed.; Elsevier Inc.: Oxford, UK, 2014; pp. 15–31. [Google Scholar]
32. Andriollo-Sanchez, M.; Hininger-Favier, I.; Meunier, N.; Venneria, E.; O’Connor, J.M.; Maiani, G.; Coudray, C.; Roussel, A.M. Age-related oxidative stress and antioxidant parameters in middle-aged and older European subjects: The ZENITH study. Eur. J. Clin. Nutr. 2005, 59, 58–62. [Google Scholar] [CrossRef]
33. Abdollahi, M.; Moridani, M.Y.; Aruoma, O.I.; Mostafalou, S. Oxidative stress in aging. Oxidative Med. Cell. Longev. 2014, 2014, 876834:1–876834:2. [Google Scholar] [CrossRef]
34. Aruoma, O.I. Free radicals, oxidative stress, and antioxidants in human health and disease. J. Am. Oil Chem. Soc. 1998, 75, 199–212. [Google Scholar] [CrossRef]
35. Saeidnia, S.; Abdollahi, M. Toxicological and pharmacological concerns on oxidative stress and related diseases. Toxicol. Appl. Pharm. 2013, 273, 442–455. [Google Scholar] [CrossRef]
36. Xie, W.; Xu, P.; Liu, Q. Antioxidant activity of water-soluble chitosan derivatives. Bioorg. Med. Chem. Lett. 2001, 11, 1699–1701. [Google Scholar] [CrossRef] [PubMed]
37. Jeon, T.I.; Hwang, S.G.; Park, N.G.; Jung, Y.R.; Shin, S.I.; Choi, S.D.; Park, D.K. Antioxidative effect of chitosan on chronic carbon tetrachloride induced hepatic injury in rats. Toxicology 2003, 187, 67–73. [Google Scholar] [CrossRef] [PubMed]
38. Chen, A.S.; Taguchi, T.; Sakai, K.; Kikuchi, K.; Wang, M.W.; Miwa, I. Antioxidant activities of chitobiose and chitotriose. Biol. Pharm. Bull. 2003, 26, 1326–1330. [Google Scholar] [CrossRef] [PubMed]
39. Sun, T.; Xie, W.; Xu, P. Superoxide anion scavenging activity of graft chitosan derivatives. Carbohydr. Polym. 2004, 58, 379–382. [Google Scholar] [CrossRef]
40. Huang, R.; Mendis, E.; Kim, S.K. Factors affecting the free radical scavenging behavior of chitosan sulfate. Int. J. Biol. Macromol. 2005, 36, 120–127. [Google Scholar] [CrossRef] [PubMed]
41. Feng, T.; Du, Y.; Li, J.; Wei, Y.; Yao, P. Antioxidant activity of half N-acetylated water-soluble chitosan in vitro. Eur. Food Res. Technol. 2007, 225, 133–138. [Google Scholar] [CrossRef]
42. Yen, M.T.; Tseng, Y.H.; Li, R.C.; Mau, J.L. Antioxidant properties of fungal chitosan from shiitake stipes. LWT-Food Sci. Technol. 2007, 40, 255–261. [Google Scholar] [CrossRef]
43. Anraku, M.; Fujii, T.; Furutani, N.; Kadowaki, D.; Maruyama, T.; Otagiri, M.; Gebicki, J.M.; Tomida, H. Antioxidant effects of a dietary supplement: Reduction of indices of oxidative stress in normal subjects by water-soluble chitosan. Food Chem, Toxicol. 2009, 47, 104–109. [Google Scholar] [CrossRef]
44. Anraku, M.; Michihara, A.; Yasufuku, T.; Akasaki, K.; Tsuchiya, D.; Nishio, H.; Maruyama, T.; Otagiri, M.; Maezaki, Y.; Kondo, Y.; et al. The antioxidative and antilipidemic effects of different molecular weight chitosans in metabolic syndrome model rats. Biol. Pharm. Bull. 2010, 33, 1994–1998. [Google Scholar] [CrossRef] [PubMed]
45. Friedman, M.; Juneja, V.K. Review of antimicrobial and antioxidative activities of chitosans in food. J. Food Prot. 2010, 73, 1737–1761. [Google Scholar] [PubMed]
46. Ngo, D.N. Chitin, Chitosan, and Their Derivatives against Oxidative Stress and Inflammation, and Some Applications. In Seafood Processing By-Products; Kim, S., Ed.; Springer: New York, NY, USA, 2014; pp. 389–405. [Google Scholar]
47. Luo, Z.; Dong, X.; Ke, Q.; Duan, Q.; Shen, L. Chitooligosaccharides inhibit ethanol-induced oxidative stress via activation of Nrf2 and reduction of MAPK phosphorylation. Oncol. Rep. 2014, 32, 2215–2222. [Google Scholar] [PubMed]
48. Anandan, R.; Ganesan, B.; Obulesu, T.; Mathew, S.; Kumar, R.S.; Lakshmanan, P.T.; Zynudheen, A.A. Dietary chitosan supplementation attenuates isoprenaline-induced oxidative stress in rat myocardium. Int. J. Biol. Macromol. 2012, 51, 783–787. [Google Scholar] [CrossRef] [PubMed]
49. Anandan, R.; Ganesan, B.; Obulesu, T.; Mathew, S.; Asha, K.K.; Lakshmanan, P.T.; Zynudheen, A.A. Antiaging effect of dietary chitosan supplementation on glutathione-dependent antioxidant system in young and aged rats. Cell Stress Chaperon 2013, 18, 121–125. [Google Scholar] [CrossRef]
50. Qiao, Y.; Bai, X.F.; Du, Y.G. Chitosan oligosaccharides protect mice from LPS challenge by attenuation of inflammation and oxidative stress. Int. Immunopharmacol. 2011, 11, 121–127. [Google Scholar] [CrossRef] [PubMed]
51. Lu, X.; Guo, H.; Sun, L.; Zhang, L.; Zhang, Y. Protective effects of sulfated chitooligosaccharides with different degrees of substitution in MIN6 cells. Int. J. Biol. Macromol. 2013, 52, 92–98. [Google Scholar] [CrossRef] [PubMed]
52. Kim, J.H.; Kim, Y.S.; Hwang, J.W.; Han, Y.K.; Lee, J.S.; Kim, S.K.; Jeon, Y.J.; Moon, S.H.; Jeon, B.T.; Bahk, Y.Y.; et al. Sulfated chitosan oligosaccharides suppress LPS-induced NO production via JNK and NF-κB inactivation. Molecules 2014, 19, 18232–18247. [Google Scholar] [CrossRef] [PubMed]
53. Tomida, H.; Fujii, T.; Furutani, N.; Michihara, A.; Yasufuku, T.; Akasaki, K.; Maruyama, T.; Otagiri, M.; Gebicki, J.M.; Anraku, M. Antioxidant properties of some different molecular weight chitosans. Carbohydr. Res. 2009, 344, 1690–1696. [Google Scholar] [CrossRef] [PubMed]
54. Zhang, W.; Xia, W. Effect of media milling on lipid-lowering and antioxidant activities of chitosan. Int. J. Biol. Macromol. 2015, 72, 1402–1405. [Google Scholar] [CrossRef]
55. Lee, D.S.; Woo, J.Y.; Ahn, C.B.; Je, J.Y. Chitosan–hydroxycinnamic acid conjugates: Preparation, antioxidant and antimicrobial activity. Food Chem. 2014, 148, 97–104. [Google Scholar] [CrossRef] [PubMed]
56. Qin, Y.; Guo, X.W.; Li, L.; Wang, H.W.; Kim, W. The antioxidant property of chitosan green tea polyphenols complex induces transglutaminase activation in wound healing. J. Med. Food. 2013, 16, 487–498. [Google Scholar] [CrossRef] [PubMed]
57. Liu, J.; Wen, X.; Lu, J.; Kan, J.; Jin, C. Free radical mediated grafting of chitosan with caffeic and ferulic acids: Structures and antioxidant activity. Int. J. Biol. Macromol. 2014, 65, 97–106. [Google Scholar] [CrossRef] [PubMed]
58. Liu, J.; Lu, J.; Kan, J.; Tang, Y.; Jin, C. Preparation, characterization and antioxidant activity of phenolic acids grafted carboxymethyl chitosan. Int. J. Biol. Macromol. 2013, 62, 85–93. [Google Scholar] [CrossRef] [PubMed]
59. Halder, S.K.; Jana, A.; Das, A.; Paul, T.; Mohapatra, P.K.D. Appraisal of antioxidant, anti-hemolytic and DNA shielding potentialities of chitosaccharides produced innovatively from shrimp shell by sequential treatment with immobilized enzymes. Food Chem. 2014, 158, 325–334. [Google Scholar] [CrossRef] [PubMed]
60. Fernandes, J.C.; Eaton, P.; Nascimento, H.; Gião, M.S.; Ramos, Ó.S.; Belo, L.; Santos-Silva, A.; Pintado, M.E.; Malcata, F.X. Antioxidant activity of chitooligosaccharides upon two biological systems: Erythrocytes and bacteriophages. Carbohydr. Polym. 2010, 79, 1101–1106. [Google Scholar] [CrossRef]
61. Ngo, D.N.; Kim, M.M.; Kim, S.K. Protective effects of aminoethyl-chitooligosaccharides against oxidative stress in mouse macrophage RAW 264.7 cells. Int. J. Biol. Macromol. 2012, 50, 624–631. [Google Scholar] [CrossRef] [PubMed]
62. Prashanth, K.V.H.; Dharmesh, S.; Rao, K.S.J.; Tharanathan, R.N. Free radical-induced chitosan depolymerized products protect calf thymus DNA from oxidative damage. Carbohydr. Res. 2007, 342, 190–195. [Google Scholar] [CrossRef] [PubMed]
63. Trinh, M.D.L.; Ngo, D.H.; Tran, D.K.; Tran, Q.T.; Vo, T.S.; Dinh, M.H.; Ngo, D.N. Prevention of H2O2-induced oxidative stress in Chang liver cells by 4-hydroxybenzyl-chitooligomers. Carbohydr. Polym. 2014, 103, 502–509. [Google Scholar] [CrossRef] [PubMed]
64. Ahn, K.S.; Aggarwal, B.B. Transcription factor NF-κB: A sensor for smoke and stress signals. Ann. N. Y. Acad. Sci. 2005, 1056, 218–233. [Google Scholar] [CrossRef] [PubMed]
65. Chung, H.Y.; Cesari, M.; Anton, S.; Marzetti, E.; Giovannini, S.; Seo, A.Y.; Carter, C.; Yu, B.P.; Leeuwenburgh, C. Molecular inflammation: Underpinnings of aging and age-related diseases. Ageing Res. Rev. 2009, 8, 18–30. [Google Scholar] [CrossRef] [PubMed]
66. Paolisso, G.; Rizzo, M.R.; Mazziotti, G.; Tagliamonte, M.R.; Gambardella, A.; Rotondi, M.; Carella, C.; Giugliano, D.; Varricchio, M.; D’Onofrio, F. Advancing age and insulin resistance: Role of plasma tumor necrosis factor-alpha. Am. J. Physiol. 1998, 275, E294–E299. [Google Scholar] [PubMed]
67. Liu, H.T.; Li, W.M.; Li, X.Y.; Xu, Q.S.; Liu, Q.S.; Bai, X.F.; Yu, C.; Du, Y.G. Chitosan oligosaccharides inhibit the expression of interleukin-6 in lipopolysaccharide-induced human umbilical vein endothelial cells through p38 and ERK1/2 protein kinases. Basic Clin. Pharmacol. Toxicol. 2010, 106, 362–371. [Google Scholar] [CrossRef] [PubMed]
68. Ma, P.; Liu, H.T.; Wei, P.; Xu, Q.S.; Bai, X.F.; Du, Y.G.; Yu, C. Chitosan oligosaccharides inhibit LPS-induced over-expression of IL-6 and TNF-α in RAW264.7 macrophage cells through blockade of mitogen-activated protein kinase (MAPK) and PI3K/Akt signaling pathways. Carbohydr. Polym. 2011, 84, 1391–1398. [Google Scholar] [CrossRef]
69. Li, Y.; Liu, H.; Xu, Q.S.; Du, Y.G.; Xu, J. Chitosan oligosaccharides block LPS-induced O-GlcNAcylation of NF-κB and endothelial inflammatory response. Carbohydr. Polym. 2014, 99, 568–578. [Google Scholar] [CrossRef] [PubMed]
70. Li, Y.; Xu, Q.; Wei, P.; Cheng, L.; Peng, Q.; Li, S.; Yin, H.; Du, Y. Chitosan oligosaccharides downregulate the expression of E-selectin and ICAM-1 induced by LPS in endothelial cells by inhibiting MAP kinase signaling. Int. J. Mol. Med. 2014, 33, 392–400. [Google Scholar] [PubMed]
71. Huang, J.; Wang, R.; Liu, X.; Zeng, X.; Wei, M. Sulfochitosan inhibits P-selectin-mediated HL-60 leukocyte adhesion under flow conditions. Cell. Mol. Biol. Lett. 2013, 18, 200–208. [Google Scholar] [CrossRef] [PubMed]
72. Ji, Q.; Deng, J.; Yu, X.; Xu, Q.; Wu, H.; Pan, J. Modulation of pro-inflammatory mediators in LPS-stimulated human periodontal ligament cells by chitosan and quaternized chitosan. Carbohydr. Polym. 2013, 92, 824–829. [Google Scholar] [CrossRef] [PubMed]
73. Fang, I.M.; Yang, C.H.; Yang, C.M. Chitosan oligosaccharides attenuate ocular inflammation in rats with experimental autoimmune anterior uveitis. Mediat. Inflamm. 2014, 2014, 827847. [Google Scholar]
74. Fang, I.M.; Yang, C.M.; Yang, C.H. Chitosan oligosaccharides prevented retinal ischemia and reperfusion injury via reduced oxidative stress and inflammation in rats. Exp. Eye Res. 2015, 130, 38–50. [Google Scholar] [CrossRef] [PubMed]
75. Hsieh, Y.L.; Yao, H.T.; Cheng, R.S.; Chiang, M.T. Chitosan reduces plasma adipocytokines and lipid accumulation in liver and adipose tissues and ameliorates insulin resistance in diabetic rats. J. Med. Food 2012, 15, 453–460. [Google Scholar] [CrossRef] [PubMed]
76. Pangestuti, R.; Bak, S.S.; Kim, S.K. Attenuation of pro-inflammatory mediators in LPS-stimulated BV2 microglia by chitooligosaccharides via the MAPK signaling pathway. Int. J. Biol. Macromol. 2011, 49, 599–606. [Google Scholar] [CrossRef] [PubMed]
77. Zhu, J.; Zhang, Y.; Wu, G.; Xiao, Z.; Zhou, H.; Yu, X. Inhibitory effects of oligochitosan on TNF-α, IL-1β and nitric oxide production in lipopolysaccharide-induced RAW264.7 cells. Mol. Med. Rep. 2015, 11, 729–733. [Google Scholar] [PubMed]
78. Mohamed, M.M. Effects of chitosan and wheat bran on serum leptin, TNF-α, lipid profile and oxidative status in animal model of non-alcoholic fatty liver. Aust. J. Basic Appl. Sci. 2011, 5, 1478–1488. [Google Scholar]
79. Yousef, M.; Pichyangkura, R.; Soodvilai, S.; Chatsudthipong, V.; Muanprasat, C. Chitosan oligosaccharide as potential therapy of inflammatory bowel disease: Therapeutic efficacy and possible mechanisms of action. Pharmacol. Res. 2012, 66, 66–79. [Google Scholar] [CrossRef] [PubMed]
80. Kim, H.M.; Hong, S.H.; Yoo, S.J.; Baek, K.S.; Jeon, Y.J.; Choung, S.Y. Differential effects of chitooligosaccharides on serum cytokine levels in aged subjects. J. Med. Food 2006, 9, 427–430. [Google Scholar] [CrossRef] [PubMed]
81. He, B.; Wang, J. Chitooligosaccharides prevent osteopenia by promoting bone formation and suppressing bone resorption in ovariectomised rats: Possible involvement of COX-2. Nat. Prod. Res. 2015, 29, 359–362. [Google Scholar] [CrossRef] [PubMed]
82. Fernandes, J.; Spindola, H.; de Sousa, V.; Alice Santos-Silva, A.; Pintado, M.E.; Malcata, F.X.; Carvalho, J.E. Anti-inflammatory activity of chitooligosaccharides in Vivo. Mar. Drugs 2010, 8, 1763–1768. [Google Scholar] [CrossRef] [PubMed]
83. Azuma, K.; Osaki, T.; Minami, S.; Okamoto, Y. Anticancer and anti-inflammatory properties of chitin and chitosan oligosaccharides. J. Funct. Biomater. 2015, 6, 33–49. [Google Scholar] [CrossRef] [PubMed]
84. Karadeniz, F.; Kim, S.K. Antidiabetic activities of chitosan and its derivatives: A mini review. In Marine Carbohydrates: Fundamentals and Applications, Part B; Kim, S., Ed.; Elsevier Inc.: Oxford, UK, 2014; pp. 15–31. [Google Scholar]
85. Ericson, U.; Sonestedt, E.; Gullberga, B.; Hellstrand, S.; Hindy, G.; Wirfält, E.; Orho-Melander, M. High intakes of protein and processed meat associate with increased incidence of type 2 diabetes. Br. J. Nutr. 2013, 109, 1143–1153. [Google Scholar] [CrossRef] [PubMed]
86. Levine, M.E.; Suarez, J.A.; Brandhorst, S.; Balasubramanian, P.; Cheng, C.W.; Madia, F.; Fontana, L.; Mirisola, M.G.; Guevara-Aguirre, J.; Wan, J.; et al. Low protein intake is associated with a major reduction in IGF-1, cancer, and overall mortality in the 65 and younger but not older population. Cell Metab. 2014, 19, 407–417. [Google Scholar] [CrossRef] [PubMed]
87. Rahimi, R.; Nikfar, S.; Larijani, B.; Abdollahi, M. A review on the role of antioxidants in the management of diabetes and its complications. Biomed. Pharmacother. 2005, 59, 365–373. [Google Scholar] [CrossRef] [PubMed]
88. Maritim, A.C.; Sanders, R.A.; Watkins, J.B., III. Diabetes, oxidative stress, and antioxidants: A review. J. Biochem. Mol. Toxicol. 2003, 17, 24–38. [Google Scholar] [CrossRef] [PubMed]
89. Giacco, F.; Brownlee, M. Oxidative stress and diabetic complications. Circ. Res. 2010, 107, 1058–1070. [Google Scholar] [CrossRef] [PubMed]
90. Saghizadeh, M.; Ong, J.M.; Garvey, W.T.; Henry, R.R.; Kern, P.A. The expression of TNF alpha by human muscle. Relationship to insulin resistance. J. Clin. Investig. 1996, 97, 1111–1116. [Google Scholar] [CrossRef] [PubMed]
91. Miura, T.; Usami, M.; Tsuura, Y.; Ishida, H.; Seino, Y. Hypoglycemic and hypolipidemic effect of chitosan in normal and neonatal streptozotocin-induced diabetic mice. Biol. Pharm. Bull. 1995, 18, 1623–1625. [Google Scholar] [CrossRef] [PubMed]
92. Hayashi, K.; Ito, M. Antidiabetic action of low molecular weight chitosan in genetically obese diabetic KK-Ay mice. Biol. Pharm. Bull. 2002, 25, 188–192. [Google Scholar] [CrossRef] [PubMed]
93. Liu, S.H.; Chang, Y.H.; Chiang, M.T. Chitosan reduces gluconeogenesis and increases glucose uptake in skeletal muscle in streptozotocin-induced diabetic rats. J. Agric. Food Chem. 2010, 58, 5795–5800. [Google Scholar] [CrossRef] [PubMed]
94. Kim, H.J.; Ahn, H.Y.; Kwak, J.H.; Shin, D.Y.; Kwon, Y.I.; Oh, C.G.; Lee, J.H. The effects of chitosan oligosaccharide (GO2KA1) supplementation on glucose control in subjects with prediabetes. Food Funct. 2014, 5, 2662–2669. [Google Scholar] [CrossRef] [PubMed]
95. Jo, S.H.; Ha, K.S.; Lee, J.W.; Kim, Y.C.; Apostolidis, E.; Kwon, Y.I. The reduction effect of low molecular weight chitosan oligosaccharide (GO2KA1) on postprandial blood glucose levels in healthy individuals. Food Sci. Biotechnol. 2014, 23, 971–973. [Google Scholar] [CrossRef]
96. Kim, J.G.; Jo, S.H.; Ha, K.S.; Kim, S.C.; Kim, Y.C.; Apostolidis, E.; Kwon, Y.I. Effect of long-term supplementation of low molecular weight chitosan oligosaccharide (GO2KA1) on fasting blood glucose and HbA1c in db/db mice model and elucidation of mechanism of action. BMC Complement. Altern. Med. 2014, 14, 272. [Google Scholar] [CrossRef] [PubMed]
97. Rong, J.X.; Rangaswamy, S.; Shen, S.; Dave, R.; Chang, Y.H.; Peterson, H.; Hodis, H.N.; Chisolm, G.M.; Sevanian, A. Arterial injury by cholesterol oxidation products causes endothelial dysfunction and arterial wall cholesterol accumulation. Arterioscl. Throm. Vas. 1998, 18, 1885–1894. [Google Scholar] [CrossRef]
98. Sevanian, A.; Hodis, H.N.; Hwang, J.; McLeod, L.L.; Peterson, H. Characterization of endothelial cell injury by cholesterol oxidation products found in oxidized LDL. J. Lipid Res. 1995, 36, 1971–1986. [Google Scholar] [PubMed]
99. Ross, R. Atherosclerosis—An inflammatory disease. N. Engl. J. Med. 1999, 340, 115–149. [Google Scholar] [CrossRef] [PubMed]
100. Cockerill, G.W.; Rye, K.A.; Gamble, J.R.; Vadas, M.A.; Barter, P.J. High-density lipoproteins inhibit cytokine-induced expression of endothelial cell adhesion molecules. Arterioscler. Thromb. Vasc. Biol. 1995, 15, 1987–1994. [Google Scholar] [CrossRef] [PubMed]
101. Ausar, S.F.; Morcillo, M.; León, A.E.; Ribotta, P.D.; Masih, R.; Vilaro Mainero, M.; Amigone, J.L.; Rubin, G.; Lescano, C.; Castagna, L.F.; et al. Improvement of HDL- and LDL-cholesterol levels in diabetic subjects by feeding bread containing chitosan. J. Med. Food 2003, 6, 397–399. [Google Scholar] [CrossRef] [PubMed]
102. Wuolijoki, E.; Hirvela, T.; Ylitalo, P. Decrease in serum LDL cholesterol with microcrystalline chitosan. Methods Find. Exp. Clin. Pharmacol. 1999, 21, 357–361. [Google Scholar] [CrossRef] [PubMed]
103. Tai, T.S.; Sheu, W.H.H.; Lee, W.J.; Yao, H.T.; Chiang, M.T. Effect of chitosan on plasma lipoprotein concentrations in type 2 diabetic subjects with hypercholesterolemia. Diabetes Care 2000, 23, 1703–1704. [Google Scholar] [CrossRef] [PubMed]
104. Kanauchi, O.; Deuchi, K.; Imasato, Y.; Shizukuishi, M.; Kobayashi, E. Mechanism for the inhibition of fat digestion by chitosan and for the synergistic effect of ascorbate. Biosci. Biotechnol. Biochem. 1995, 59, 786–790. [Google Scholar] [CrossRef] [PubMed]
105. Rizzo, M.; Giglio, R.V.; Nikolic, D.; Patti, A.M.; Campanella, C.; Cocchi, M.; Katsiki, N.; Montalto, G. Effects of chitosan on plasma lipids and lipoproteins: A 4-month prospective pilot study. Angiology 2013, 65, 538–542. [Google Scholar] [CrossRef] [PubMed]
106. Liu, J.; Zhang, J.; Xia, W. Hypocholesterolaemic effects of different chitosan samples in vitro and in vivo. Food Chem. 2008, 107, 419–425. [Google Scholar] [CrossRef]
107. Choi, C.R.; Kim, E.K.; Kim, Y.S.; Je, J.Y.; An, S.H.; Lee, J.D.; Wang, J.H.; Ki, S.S.; Jeon, B.T.; Moon, S.H.; et al. Chitooligosaccharides decreases plasma lipid levels in healthy men. Int. J. Food Sci. Nutr. 2012, 63, 103–106. [Google Scholar] [CrossRef] [PubMed]
108. Park, J.H.; Hong, E.K.; Ahn, J.; Kwak, H.S. Properties of nanopowdered chitosan and its cholesterol lowering effect in rats. Food Sci. Biotechnol. 2010, 19, 1457–1462. [Google Scholar] [CrossRef]
109. Chiang, M.T.; Yao, H.T.; Chen, H.C. Effect of dietary chitosans with different viscosity on plasma lipids and lipid peroxidation in rats fed on a diet enriched with cholesterol. Biosci. Biotechnol. Biochem. 2000, 64, 965–971. [Google Scholar] [CrossRef] [PubMed]
110.Bokura, H.; Kobayashi, S. Chitosan decreases total cholesterol in women: A randomized, double-blind, placebo-controlled trial. Eur. J. Clin. Nutr. 2003, 57, 721–725. [Google Scholar] [CrossRef] [PubMed]
111. Zhang, J.; Zhang, W.; Mamadouba, B.; Xia, W. A comparative study on hypolipidemic activities of high and low molecular weight chitosan in rats. Int. J. Biol. Macromol. 2012, 51, 504–508. [Google Scholar] [CrossRef] [PubMed]
112. Rashid, T.U.; Shamsuddin, S.M.; Khan, M.A.; Rahman, M.M. Evaluation of Fat Binding Capacity of Gamma Irradiated Chitosan Extracted from Prawn Shell. Soft Mater. 2014, 12, 262–267. [Google Scholar] [CrossRef]
113. Patti, A.M.; Katsiki, N.; Nikolic, D.; Al-Rasadi, K.; Rizzo, M. Nutraceuticals in lipid-lowering treatment a narrative review on the role of chitosan. Angiology 2014. [Google Scholar] [CrossRef]
114. Das, R.K.; Kasoju, N.; Bora, U. Encapsulation of curcumin in alginate-chitosan-pluronic composite nanoparticles for delivery to cancer cells. Nanomedicine 2010, 6, 153–160. [Google Scholar] [CrossRef] [PubMed]
115. Duan, J.; Zhang, Y.; Han, S.; Chen, Y.; Li, B.; Liao, M.; Chen, W.; Deng, X.; Zhao, J.; Huang, B. Synthesis and in vitro/in vivo anti-cancer evaluation of curcumin-loaded chitosan/poly(butyl cyanoacrylate) nanoparticles. Int. J. Pharm. 2010, 400, 211–220. [Google Scholar] [CrossRef] [PubMed]
116. Rejinold, N.S.; Muthunarayanan, M.; Divyarani, V.V.; Sreerekha, P.R.; Chennazhi, K.P.; Nair, S.V.; Tamura, H.; Jayakumar, R. Curcumin-loaded biocompatible thermoresponsive polymeric nanoparticles for cancer drug delivery. J. Colloid Interface Sci. 2011, 360, 39–51. [Google Scholar] [CrossRef] [PubMed]
117. Zaki, N. Progress and problems in nutraceuticals delivery. J. Bioequivalence Bioavailab. 2014, 6, 75–77. [Google Scholar] [CrossRef]
118. Tang, H.; Murphy, C.J.; Zhang, B.; Shen, Y.; van Kirk, E.A.; Murdoch, W.J.; Radosz, M. Curcumin polymers as anticancer conjugates. Biomaterials 2010, 31, 7139–7149. [Google Scholar] [CrossRef] [PubMed]
119. Shaikh, J.; Ankola, D.D.; Beniwal, V.; Singh, D.; Kumar, M.N. Nanoparticle encapsulation improves oral bioavailability of curcumin by at least 9-fold when compared to curcumin administered with piperine as absorption enhancer. Eur. J. Pharm. Sci. 2009, 37, 223–230. [Google Scholar] [CrossRef] [PubMed]
120. Prajakta, D.; Ratnesh, J.; Chandan, K.; Suresh, S.; Grace, S.; Meera, V.; Vandana, P. Curcumin loaded pH-sensitive nanoparticles for the treatment of colon cancer. J. Biomed. Nanotechnol. 2009, 5, 445–455. [Google Scholar] [CrossRef] [PubMed]
121. Narayanan, N.K.; Nargi, D.; Randolph, C.; Narayanan, B.A. Liposome encapsulation of curcumin and resveratrol in combination reduces prostate cancer incidence in PTEN knockout mice. Int. J. Cancer 2009, 125, 1–8. [Google Scholar] [CrossRef] [PubMed]
122. Mazzarino, L.; Loch-Neckel, G.; Bubniak, L.D.S.; Mazzucco, S.; Santos-Silva, M.C.; Borsali, R.; Lemos-Senna, E. Curcumin-loaded chitosan-coated nanoparticles as a new approach for the local treatment of oral cavity cancer. J. Nanosci. Nanotechnol. 2015, 15, 781–791. [Google Scholar] [CrossRef]
123. Mazzarino, L.; Borsali, R.; Lemos-Senna, E. Mucoadhesive films containing chitosan-coated nanoparticles: A new strategy for buccal curcumin release. J. Pharm. Sci. 2014, 103, 3764–3771. [Google Scholar] [CrossRef] [PubMed]
124. Mazzarino, L.; Otsuka, I.; Halila, S.; Bubniak Ldos, S.; Mazzucco, S.; Santos-Silva, M.C.; Lemos-Senna, E.; Borsali, R. Xyloglucan-block-Poly(ϵ-Caprolactone) Copolymer Nanoparticles Coated with Chitosan as Biocompatible Mucoadhesive Drug Delivery System. Macromol. Biosci. 2014, 14, 709–719. [Google Scholar] [CrossRef] [PubMed]
125. Mazzarino, L.; Coche-Guérente, L.; Lemos-Senna, E.; Borsali, R. On the mucoadhesive properties of chitosan-coated polycaprolactone nanoparticles loaded with curcumin using quartz crystal microbalance with dissipation monitoring. J. Biomed. Nanotechnol. 2014, 10, 787–794. [Google Scholar] [CrossRef] [PubMed]
126. Khan, N.; Adhami, V.M.; Siddiqui, I.A.; Bharali, D.J.; Mousa, S.A.; Mukhtar, H. Abstract 5438: Oral administration of naturally occurring chitosan based nanoformulated green tea polyphenol EGCG effectively inhibits prostate cancer cell growth in a xenograft model. In Proceedings of the 103rd Annual Meeting of the American Association for Cancer Research, Chicago, IL, USA, 31 March–4 April 2012; AACR: Philadelphia, PA, USA, 2012. [Google Scholar]
127. De Pace, R.C.; Liu, X.; Sun, M.; Nie, S.; Zhang, J.; Cai, Q.; Gao, W.; Pan, X.; Fan, Z.; Wang, S.; et al. Anticancer activities of (−)-epigallocatechin-3-gallate encapsulated nanoliposomes in MCF7 breast cancer cells. J. Liposome Res. 2013, 23, 187–196. [Google Scholar] [CrossRef] [PubMed]
128. Anitha, A.; Deepa, N.; Chennazhi, K.P.; Lakshmanan, V.K.; Jayakumar, R. Combinatorial anticancer effects of curcumin and 5-fluorouracil loaded thiolated chitosan nanoparticles towards colon cancer treatment. Biochim. Biophys. Acta (BBA)—Gen. Subj. 2014, 1840, 2730–2743. [Google Scholar] [CrossRef]
129. Anitha, A.; Sreeranganathan, M.; Chennazhi, K.P.; Lakshmanan, V.K.; Jayakumar, R. In vitro combinatorial anticancer effects of 5-fluorouracil and curcumin loaded N,O-carboxymethyl chitosan nanoparticles toward colon cancer and in vivo pharmacokinetic studies. Eur. J. Pharm. Biopharm. 2014, 88, 238–251. [Google Scholar] [CrossRef] [PubMed]
130. Prabaharan, M. Chitosan-based nanoparticles for tumor-targeted drug delivery. Int. J. Biol. Macromol. 2015, 72, 1313–1322. [Google Scholar] [CrossRef] [PubMed]
131. Wang, J.J.; Zeng, Z.W.; Xiao, R.Z.; T Xie, T.; Zhou, G.L.; Zhan, X.R.; Wang, S.L. Recent advances of chitosan nanoparticles as drug carriers. Int. J. Nanomed. 2011, 6, 765–774. [Google Scholar]
132. Dube, A.; Nicolazzo, J.A.; Larson, I. Chitosan nanoparticles enhance the intestinal absorption of the green tea catechins (+)-catechin and (−)-epigallocatechin gallate. Eur. J. Pharm. Sci. 2010, 41, 219–225. [Google Scholar] [CrossRef] [PubMed]
133. Dube, A.; Nicolazzo, J.A.; Larson, I. Chitosan nanoparticles enhance the plasma exposure of (−)-epigallocatechin gallate in mice through an enhancement in intestinal stability. Eur. J. Pharm. Sci. 2011, 44, 422–426. [Google Scholar] [CrossRef] [PubMed]
134. Hu, B.; Ting, Y.; Yang, X.; Tang, W.; Zeng, X.; Huang, Q. Nanochemoprevention by encapsulation of (−)-epigallocatechin-3-gallate with bioactive peptides/chitosan nanoparticles for enhancement of its bioavailability. Chem. Commun. 2012, 48, 2421–2423. [Google Scholar] [CrossRef]
135. Tang, D.W.; Yu, S.H.; Ho, Y.C.; Huang, B.Q.; Tsai, G.J.; Hsieh, H.Y.; Sung, H.W.; Mi, F.L. Characterization of tea catechins-loaded nanoparticles prepared from chitosan and an edible polypeptide. Food Hydrocolloids 2013, 30, 33–41. [Google Scholar] [CrossRef]
136. Oehlke, K.; Adamiuk, M.; Behsnilian, B.; Gräf, V.; Mayer-Miebach, E.; Walz, E.; Greine, R. Potential bioavailability enhancement of bioactive compounds using food-grade engineered nanomaterials: A review of the existing evidence. Food Funct. 2014, 5, 1341–1359. [Google Scholar] [CrossRef] [PubMed]
137. Sadeghi, A.M.; Dorkoosh, F.A.; Avadi, M.R.; Weinhold, M.; Bayat, A.; Delie, F.; Gurny, R.; Larijani, B.; Rafiee-Tehrani, M.; Junginger, H.E. Permeation enhancer effect of chitosan and chitosan derivatives: Comparison of formulations as soluble polymers and nanoparticulate systems on insulin absorption in Caco-2 cells. Eur. J. Pharm. Biopharm. 2008, 70, 270–278. [Google Scholar] [CrossRef] [PubMed]
138. Vllasaliu, D.; Exposito-Harris, R.; Heras, A.; Casettari, L.; Garnett, M.; Illum, L.; Stolnik, S. Tight junction modulation by chitosan nanoparticles: Comparison with chitosan solution. Int. J. Pharm. 2010, 400, 183–193. [Google Scholar] [CrossRef] [PubMed]
139. Li, Z.; Ha, J.; Zou, T.; Gu, L. Fabrication of coated bovine serum albumin (BSA)–epigallocatechin gallate (EGCG) nanoparticles and their transport across monolayers of human intestinal epithelial Caco-2 cells. Food Funct. 2014, 5, 1278–1285. [Google Scholar] [CrossRef] [PubMed]
140. Zhang, J.; Nie, S.; Wang, S. Nanoencapsulation Enhances Epigallocatechin-3-gallate Stability and Its Antiatherogenic Bioactivities in Macrophages. J. Agric. Food Chem. 2013, 61, 9200–9209. [Google Scholar] [CrossRef] [PubMed]
141. Hong, Z.; Xu, Y.Q.; Yin, J.F.; Jin, J.; Du, Q. Improving the Effectiveness of (−)-Epigallocatechin Gallate (EGCG) against Rabbit Atherosclerosis by EGCG-Loaded Nanoparticles Prepared from Chitosan and Polyaspartic Acid. J. Agric. Food Chem. 2014, 62, 12603–12609. [Google Scholar] [CrossRef] [PubMed]
142. Liang, J.; Cao, L.; Zhang, L.; Wan, X.C. Preparation, characterization, and in vitro antitumor activity of folate conjugated chitosan coated EGCG nanoparticles. Food Sci. Biotechnol. 2014, 23, 569–575. [Google Scholar] [CrossRef]
143. Singh, B.N.; Shankar, S.; Srivastava, R.K. Green tea catechin, epigallocatechin-3-gallate (EGCG): Mechanisms, perspectives and clinical applications. Biochem. Pharmacol. 2011, 82, 1807–1821. [Google Scholar] [CrossRef] [PubMed]
144. Sanna, V.; Roggio, A.M.; Pala, N.; Marceddu, S.; Lubinu, G.; Mariani, A.; Sechi, M. Effect of chitosan concentration on PLGA microcapsules for controlled release and stability of resveratrol. Int. J. Biol. Macromol. 2015, 72, 531–536. [Google Scholar] [CrossRef] [PubMed]
145. Alzheimer’s Association. Alzheimer’s disease facts and figures. Alzheimers Dement. 2012, 8, 131–168. [Google Scholar]
146. Bieschke, J. Natural compounds may open new routes to treatment of amyloid diseases. Neurotherapeutics 2013, 10, 429–439. [Google Scholar] [CrossRef] [PubMed]
147. Kim, M.S.; Sung, M.J.; Seo, S.B.; Yoo, S.J.; Lim, W.K.; Kim, H.M. Water-soluble chitosan inhibits the production of pro-inflammatory cytokine in human astrocytoma cells activated by amyloid beta peptide and interleukin-1beta. Neurosci. Lett. 2002, 321, 105–109. [Google Scholar] [CrossRef] [PubMed]
148. Wei, P.; Ma, P.; Xu, Q.S.; Bai, Q.H.; Gu, J.G.; Xi, H.; Du, Y.G.; Yu, C. Chitosan oligosaccharides suppress production of nitric oxide in lipopolysaccharide-induced N9 murine microglial cells in vitro. Glycoconjugate J. 2012, 29, 285–295. [Google Scholar] [CrossRef]
149. Howlett, G.J.; Moore, K.J. Untangling the role of amyloid in atherosclerosis. Curr. Opin. Lipidol. 2006, 17, 541–547. [Google Scholar] [CrossRef] [PubMed]
150. Herczenik, E.; Gebbink, M.F.B.G. Molecular and cellular aspects of protein misfolding and disease. FASEB J. 2008, 22, 2115–2133. [Google Scholar] [CrossRef] [PubMed]
151. Korporaal, S.J.; Gorter, G.; van Rijn, H.J.; Akkerman, J.W. Effect of oxidation on the platelet-activating properties of low-density lipoprotein. Arterioscler. Thromb. Vasc. Biol. 2005, 25, 867–872. [Google Scholar] [CrossRef] [PubMed]
152. Herczenik, E.; Bouma, B.; Korporaal, S.J.A.; Strangi, R.; Zeng, Q.; Gros, P.; van Eck, M.; van Berkel, T.J.C.; Gebbink, M.F.B.G.; Akkerman, J.W.N. Activation of Human Platelets by Misfolded Proteins. Arterioscler. Thromb. Vasc. Biol. 2007, 27, 1657–1665. [Google Scholar] [CrossRef] [PubMed]
153. Ursini, F.; Davies, K.J.; Maiorino, M.; Parasassi, T.; Sevanian, A. Atherosclerosis: Another protein misfolding disease? Trends Mol. Med. 2002, 8, 370–374. [Google Scholar] [CrossRef] [PubMed]
154. Hayden, M.R.; Tyagi, S.C.; Kerklo, M.M.; Nicolls, M.R. Type 2 diabetes mellitus as a conformational disease. JOP 2005, 6, 287–302. [Google Scholar] [PubMed]
155. Stewart, C.R.; Tseng, A.A.; Mok, Y.F.; Staples, M.K.; Schiesser, C.H.; Lawrence, L.J.; Varghese, J.N.; Moore, K.J.; Howlett, G.J. Oxidation of low-density lipoproteins induces amyloid-like structures that are recognized by macrophages. Biochemistry 2005, 44, 9108–9116. [Google Scholar] [CrossRef] [PubMed]
156. Kowalska, M.A.; Badellino, K. β-Amyloid protein induces platelet aggregation and supports platelet adhesion. Biochem Biophys. Res. Commun. 1994, 205, 1829–1835. [Google Scholar] [CrossRef] [PubMed]
157. Laske, C.; Sopova, K.; Stellos, K. Platelet activation in alzheimer’s disease: From pathophysiology to clinical value. Curr. Vasc. Pharmacol. 2012, 10, 626–630. [Google Scholar] [CrossRef] [PubMed]
158. Ho, C.; Stubbs, C.D. Hydration at the membrane protein-lipid interface. Biophys. J. 1992, 63, 897–902. [Google Scholar] [CrossRef] [PubMed]
159. Anraku, M.; Kabashima, M.; Namura, H.; Maruyama, T.; Otagiri, M.; Gebicki, J.M.; Furutani, N.; Tomida, H. Antioxidant protection of human serum albumin by chitosan. Int. J. Biol. Macromol. 2008, 43, 159–164. [Google Scholar] [CrossRef] [PubMed]
160. Arakawa, T.; Prestrelski, S.J.; Kenney, W.C.; Carpenter, J.F. Factors affecting short-term and long-term stabilities of proteins. Adv. Drug Deliv. Rev. 1993, 10, 1–28. [Google Scholar] [CrossRef]
161. Lahm, D.; Lee, L.K.; Bettelheim, F.A. Age dependence of freezable and nonfreezable water content of normal human lenses. Investig. Ophthalmol. Vis. Sci. 1985, 26, 1162–1165. [Google Scholar]
162. Kerch, G.; Rustichelli, F.; Ausili, P.; Zicans, J.; Merijs Meri, R.; Glonin, A. Effect of chitosan on physical and chemical processes during bread baking and staling. Eur. Food Res. Technol. 2008, 226, 1459–1464. [Google Scholar] [CrossRef]
163. Kerch, G.; Zicans, J.; Merijs Meri, R.; Stunda-Ramava, A.; Jakobsons, E. The use of thermal analysis in assessing the effect of bound water content and substrate rigidity on prevention of platelet adhesion. J. Therm. Anal. Calorim. 2015, 120, 533–539. [Google Scholar] [CrossRef]
164. No, H.K.; Meyers, S.P.; Prinyawiwatkul, W.; Xu, Z. Applications of chitosan for improvement of quality and shelf life of foods: A review. J. Food Sci. 2007, 72, R87–R100. [Google Scholar] [CrossRef] [PubMed]
165. Park, I.K.; Lee, Y.K.; Kim, M.J.; Kim, S.D. Effect of surface treatment with chitosan on shelf-life of baguette. J. Chitin Chitosan 2002, 7, 208–213. [Google Scholar]
166. Ahn, D.H.; Choi, J.S.; Lee, H.Y.; Kim, J.Y.; Youn, S.K.; Park, S.M. Effects on preservation and quality of bread with coating high molecular weight chitosan. Korean J. Food Nutr. 2003, 16, 430–436. [Google Scholar]
167. Park, I.K.; Lee, Y.K.; Kim, M.J.; Kim, S.D. Effect of surface treatment with chito-oligosaccharide on shelf-life of baguette. J. Chitin Chitosan 2002, 7, 214–218. [Google Scholar]
168. Lee, H.Y.; Kim, S.M.; Kim, J.Y.; Youn, S.K.; Choi, J.S.; Park, S.M.; Ahn, D.H. Effect of addition of chitosan on improvement for shelf-life of bread. J. Korean Soc. Food Sci. Nutr. 2002, 31, 445–450. [Google Scholar] [CrossRef]
169. Lee, K.H.; Lee, Y.C. Effect of carboxymethyl chitosan on quality of fermented pan bread. Korean J. Food Sci. Technol. 1997, 29, 96–100. [Google Scholar]
170. Kerch, G.; Zicans, J.; Merijs Meri, R. The effect of chitosan oligosaccharides on bread staling. J. Cereal Sci. 2010, 52, 491–495. [Google Scholar] [CrossRef]
171. Knorr, D. Functional properties of chitin and chitosan. J. Food Sci. 1982, 47, 593–595. [Google Scholar] [CrossRef]
172. Lafarga, T.; Gallagher, E.; Walsh, D.; Valverde, J.; Hayes, M. Chitosan-containing bread made using marine shellfishery byproducts: Functional, bioactive, and quality assessment of the end product. J. Agric. Food Chem. 2013, 61, 8790–8796. [Google Scholar] [CrossRef] [PubMed]
173. Fadda, C.; Sanguinetti, A.M.; Del Caro, A.; Collar, C.; Piga, A. Bread staling: updating the view. Compr. Rev. Food Sci. Food Saf. 2014, 13, 473–492. [Google Scholar] [CrossRef]
174. Lafarga, T.; Hayes, M.; Valverde, J.; Walsh, D.; Gallagher, E. Prawn chitosan containing bread: assessment of functional, bioactive and sensory qualities. J. Chitin Chitosan Sci. 2013, 1, 150–156. [Google Scholar] [CrossRef]
175. Kerch, G.; Glonin, A.; Zicans, J.; Merijs Meri, R. A DSC study of the effect of ascorbic acid on bound water content and distribution in chitosan-enriched bread rolls during storage. J. Therm. Anal. Calorim. 2012, 108, 73–78. [Google Scholar] [CrossRef]
176. Rakcejeva, T.; Rusa, K.; Dukalska, L.; Kerch, G. Effect of chitosan and chitooligosaccharide lactate on free lipids and reducing sugars content and on wheat bread firming. Eur. Food Res. Technol. 2011, 232, 123–128. [Google Scholar] [CrossRef]
177. Kerch, G.; Glonin, A.; Zicans, J.; Merijs Meri, R. A DSC study of the effect of bread making methods on bound water content and redistribution in chitosan enriched bread. J. Therm. Anal. Calorim. 2012, 108, 185–189. [Google Scholar] [CrossRef]
178. Lee, J.W.; Lee, Y.C. The physico-chemical and sensory properties of milk with water soluble chitosan. Korean J. Food Sci. Technol. 2000, 32, 806–813. [Google Scholar]
179. El-Sisi, A.S. Impact of replacement of gelatin with chitosan on the physicochemical properties of ice-milk. Int. J. Dairy Sci. 2015, 10, 26–33. [Google Scholar]
180. Kwak, H.S.; Mijan, M.A.; Ganesan, P. Application of Nanomaterials, Nano- and Microencapsulation to Milk and Dairy Products, in Nano- and Microencapsulation for Foods; Kwak, H.-S., Ed.; John Wiley & Sons, Ltd: Chichester, UK, 2014. [Google Scholar] [CrossRef]
181. Zanjani, M.A.K.; Mohammadi, N.; Ahari, H.; Tarzi, B.G.; Bakhoda, H. Effect of microencapsulation with chitosan coating on survival of Lactobacillus casei and Bifidobacterium bifidum in ice cream. Iran. J. Nutr. Sci. Food. Technol. 2014, 8, 125–134. [Google Scholar]
182. Eduardo, M.F.; Correa De Mello, K.G.P.; Polakiewicz, B.; Da Silva Lannes, S.C. Evaluation of chocolate milk beverage formulated with modified chitosan. J. Agric. Sci. Technol. 2014, 16, 1301–1312. [Google Scholar]
183. Tasneem, M.; Siddique, F.; Ahmad, A.; Farooq, U. Stabilizers: Indispensable substances in dairy products of high rheology. Crit. Rev. Food Sci. Nutr. 2014, 54, 869–879. [Google Scholar] [CrossRef] [PubMed]
184. Zagorska, J.; Pelnik, A.; Kerch, G. Effect of the addition of chitosans with different molecular structure on fermentation process and viscosity changes during sour cream storage. Biochem. Biophys. (BAB) 2013, 1, 13–21. [Google Scholar]
185. Rajapaksha, D.S.W.; Kodithuwakku, K.A.H.T. Evaluation of chitosan for its inhibitory activity on post-acidification of set yoghurt under cold storage for 20 days. J. Chitin Chitosan 2014, 2, 16–20. [Google Scholar] [CrossRef]
186. Seo, M.H.; Chang, Y.H.; Lee, S.; Kwak, H.S. The physicochemical and sensory properties of milk supplemented with ascorbic acid-soluble nano-chitosan during storage. Int. J. Dairy Technol. 2011, 64, 57–63. [Google Scholar] [CrossRef]
187. Choi, H.J.; Ahn, J.; Kim, N.C.; Kwak, H.S. The Effects of Microencapsulated chitooligosaccharide on physical and sensory properties of the milk. Asian Aust. J. Anim. Sci. 2006, 19, 1347–1353. [Google Scholar] [CrossRef]
188. Krasaekoopt, W.; Bhandari, B.; Deeth, H.C. Survival of probiotics encapsulated in chitosan-coated alginate beads in yoghurt from UHT-and conventionally treated milk during storage. LWT-Food Sci. Technol. 2006, 39, 177–183. [Google Scholar] [CrossRef]
189. Seo, M.H.; Lee, S.Y.; Chang, Y.H.; Kwak, H.S. Physicochemical, microbial, and sensory properties of yogurt supplemented with nanopowdered chitosan during storage. J. Dairy Sci. 2009, 92, 5907–5916. [Google Scholar] [CrossRef] [PubMed]
190. Altieri, C.; Scrocco, C.; Sinigaglia, M.; del Nobile, M.A. Use of chitosan to prolong mozzarella cheese shelf life. J. Dairy Sci. 2005, 88, 2683–2688. [Google Scholar] [CrossRef] [PubMed]
© 2015 by the authors; licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution license (http://creativecommons.org/licenses/by/4.0/).






